
分析 (1)从是否产生污染和原料的利用率角度分析考虑;
(2)温度恒定受热均匀,便于控制的角度分析;检验硫酸根应先加入盐酸,无现象再加入氯化钡;
(3)洗涤的目的除去表面附着的杂质;
(4)①浓硫酸吸收水,碱石灰吸收二氧化碳,所以由题可知:n(H2O)=$\frac{1.8g}{18g/mol}$=0.1 mol,n(CO2)=$\frac{8.8g}{44g/mol}$=0.2 mol,所以的最简正整为:m=1,n=2,由此分析解答;
②根据原子守恒配平,来确定各物质前面的系数.
解答 解:(1)方案1和方案2相比较,方案1产生污染性气体,且生成相同物质的量的硫酸铜时,方案1消耗的硫酸多,
故答案为:方案2;方案2无染污,且节约原料;
(2)温度恒定受热均匀,便于控制的角度分析,用水浴加热;检验硫酸根应先加入盐酸,排除CO32-、SO32- 以及Ag+的干扰,再加入氯化钡溶液有白色沉淀生成,则含有SO42-,故答案为:水浴加热;取滤液少许,加入盐酸无明显现象,加入氯化钡有白色沉淀生成;
(3)沉淀表面附有可溶性的离子应洗涤除去,故答案为:除去产品表面杂质;
(4)①浓硫酸吸收水,碱石灰吸收二氧化碳,所以由题可知:n(H2O)=$\frac{1.8g}{18g/mol}$=0.1 mol,n(CO2)=$\frac{8.8g}{44g/mol}$=0.2 mol,所以的最简正整为:m=1,n=2,则该碱式碳酸铜的化学式为:Cu(OH)2•2CuCO3,故答案为:Cu(OH)2•2CuCO3;
②根据原子守恒配平得:mCu(OH)2•nCuCO3+(m+n)H2$\frac{\underline{\;\;△\;\;}}{\;}$(m+n)Cu+nCO2+(2m+n)H2O,故答案为:(m+n);(m+n);n;(2m+n).
点评 本题考查制备硫酸铜和硫酸根离子的检验的实验设计和化学式的确定,明确离子的性质是解答本题关键,题目难度中等.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题
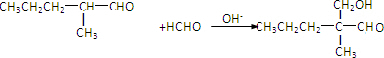 .
. .
.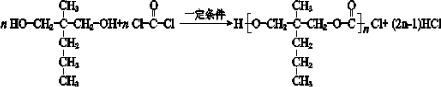 .
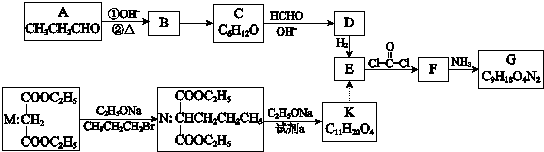
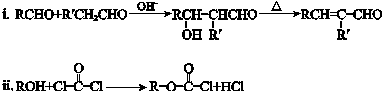
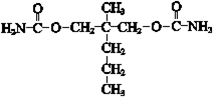
.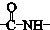 ”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2.则P的结构简式是
”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2.则P的结构简式是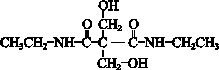 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝与V2O5发生铝热反应 | B. | 镁粉投入到FeCl3溶液中 | ||
| C. | 碳粉与CuO混合物在试管中加热 | D. | 水蒸气通入足量Na2O2粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al 1s22s22p63s23p1 | B. | O2- 1s22s22p4 | ||
| C. | Na 1s22s22p63s1 | D. | F 1s22s22p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
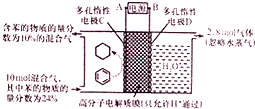 一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )
一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )| A. | 导线中电子转移方向为C到A | |
| B. | 阳极生成2.8mol气体时,转移电子为11.2mol | |
| C. | 生成目标产物的电极反应式为C6H6+6H++6e-=C6H12 | |
| D. | 该储氢装置的电流效率η=64.3%(η=$\frac{生成目标产物消耗的电子数}{转移的电子总数}$×100%) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| PH | 6.10 | 7.35 | 7.40 | 7.45 |
| A. | pH=7.30的血液中,HCO3-的水解程度一定大于H2CO3的电离程度 | |
| B. | 人体血液酸中毒时,可注射NaHCO3溶液缓解 | |
| C. | pH=7.00的血液中,c(H2CO3)<c(HCO3-) | |
| D. | 正常人体血液中,HCO3-的水解程度大于它的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com