
【题目】研究含氮和含硫化合物的性质在工业生产和环境保护中有重要意义。
(1)制备硫酸可以有如下两种途径:
2SO2(g)+O2(g)=2SO3(g) △H=-198kJ·mol-1
SO2(g)+NO2(g)=SO3(g)+NO(g) △H=-41.8kJ·mol-1
若CO的燃烧热为283 kJ·mol-1,则1molNO2和1mol CO 反应生成CO2和NO的能量变化示意图中E2= _________kJ·mol-1

(2)锅炉烟道气含CO、SO2,可通过如下反应回收硫:2CO(g)+SO2(g)![]() S(I)+2CO2(g)。某温度下在2L恒容密闭容器中通入2 molSO2和一定量的CO发生反应,5min后达到平衡,生成1molCO2。其他条件不变时SO2的平衡转化率反应温度的变化如图A,请解释其原因:_________
S(I)+2CO2(g)。某温度下在2L恒容密闭容器中通入2 molSO2和一定量的CO发生反应,5min后达到平衡,生成1molCO2。其他条件不变时SO2的平衡转化率反应温度的变化如图A,请解释其原因:_________
②第8分钟时,保持其他条件不变,将容器体积迅速压缩至1L,在10分钟时达到平衡,CO的物质的量变化了1mol。请在图B中画出SO2浓度从6~11分钟的变化曲线。

(3)己知某温度下,H2SO3的电离常数为K1≈l.5×10-2, K2≈1.0×10-7,用NaOH溶液吸收SO2,当溶液中HSO3-, SO32-离子相等时,溶液的pH值约为_________
(4)连二亚硫酸钠(Na2S2O4)具有强还原性,废水处理时可在弱酸性条件下加入亚硫酸氢钠电解产生连二亚硫酸根,进而将废水中的HNO2还原成无害气体排放,连二亚硫酸根氧化为原料循环电解。产生连二亚硫酸根的电极反应式为_________,连二亚硫酸根与HNO2反应的离子方程式_________。
【答案】 359.8kJ·mol-1 正反应放热,温度升高平衡逆向移动,SO2平衡转化率降低。温度高于445℃后硫变成气态,正反应吸热,温度升高平衡正向移动, SO2平衡转化率增加。 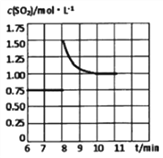 7 2HSO3-+2e-+2H+=S2O42-+2H2O 3S2O42-+2HNO2+2H2O =6HSO3-+N2 ↑
7 2HSO3-+2e-+2H+=S2O42-+2H2O 3S2O42-+2HNO2+2H2O =6HSO3-+N2 ↑
【解析】(1)已知:① 2SO2(g)+O2(g)=2SO3(g) △H1=-198kJ·mol-1,②SO2(g)+NO2(g)=SO3(g)+NO(g) △H2=-41.8kJ·mol-1,③CO(g) +![]() O2(g) =CO2(g) △H3=-213kJ·mol-1,根据盖斯定律可知,由②+③-①×
O2(g) =CO2(g) △H3=-213kJ·mol-1,根据盖斯定律可知,由②+③-①×![]() 可得NO2(g) +CO(g) =CO2(g) +NO(g) ,即△H= (-41.8kJ·mol-1)+(-213kJ·mol-1)-(-198kJ·mol-1)×
可得NO2(g) +CO(g) =CO2(g) +NO(g) ,即△H= (-41.8kJ·mol-1)+(-213kJ·mol-1)-(-198kJ·mol-1)×![]() =-155.8kJ·mol-1,则E2=E1-△H=(134kJ·mol-1)-(-225.8kJ·mol-1)=359.8kJ·mol-1 ;
=-155.8kJ·mol-1,则E2=E1-△H=(134kJ·mol-1)-(-225.8kJ·mol-1)=359.8kJ·mol-1 ;
(2)①由图示可知SO2的平衡转化率随反应温度的变化是先降低,但当温度达到后445℃,再升温,转化率反应而升高,出现此现象的可能原因是:正反应放热,温度升高平衡逆向移动,SO2平衡转化率降低。温度高于445℃后硫变成气态,正反应吸热,温度升高平衡正向移动, SO2平衡转化率增加;
②某温度下在2L恒容密闭容器中发生2CO(g)+SO2(g)![]() S(l)+2CO2(g),通入2 molSO2和一定量的CO发生反应,5min后达到平衡,生成1molCO2,此时SO2的物质的量为1.5mol,浓度为0.75mol/L;第8分钟时,保持其他条件不变,将容器体积迅速压缩至1L,此时SO2的浓度为1.5mol/L,此时平衡会正向进行,10分钟时达到平衡,CO的物质的量变化了1mol。SO2变化0.5mol,重新平衡时SO2的浓度为
S(l)+2CO2(g),通入2 molSO2和一定量的CO发生反应,5min后达到平衡,生成1molCO2,此时SO2的物质的量为1.5mol,浓度为0.75mol/L;第8分钟时,保持其他条件不变,将容器体积迅速压缩至1L,此时SO2的浓度为1.5mol/L,此时平衡会正向进行,10分钟时达到平衡,CO的物质的量变化了1mol。SO2变化0.5mol,重新平衡时SO2的浓度为![]() =1mol/L,可得SO2浓度从6~11分钟的变化曲线为
=1mol/L,可得SO2浓度从6~11分钟的变化曲线为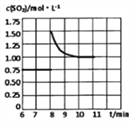 ;
;
(3)根据HSO3-![]() SO32-+H+平衡常数K=
SO32-+H+平衡常数K= =1.0×10-7,此时HSO3-, SO32-离子相等,则c(H+)=1.0×10-7mol/L,溶液的pH=7;
=1.0×10-7,此时HSO3-, SO32-离子相等,则c(H+)=1.0×10-7mol/L,溶液的pH=7;
(4)亚硫酸氢钠电解产生连二亚硫酸根发生还原反应,应在电解池的阴极进行,电极反应为2HSO3-+2e-+2H+=S2O42-+2H2O;连二亚硫酸根与HNO2反应生成无毒气体为氮气,则HNO2发生还原反应,连二亚硫酸根发生氧化反应生成HSO3-,则发生反应的离子方程式为3S2O42-+2HNO2+2H2O =6HSO3-+N2↑。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质的用途说法错误的是
A. 乙醇可用作燃料 B. SO2可用作漂白剂
C. Al2O3可用作耐火材料 D. Fe3O4办可用作红色涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
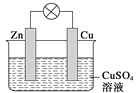
【题目】在铜锌原电池中,以硫酸铜为电解质溶液,锌为________极,电极上发生的是________(填“氧化”或“还原”)反应,电极反应式为___________。
锌片上观察到的现象为________;铜为________极,电极上发生的是________(填“氧化”或“还原”)反应,电极反应式是________;铜片上观察到的现象是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体物质的质量减小的是
A. 二氧化硅和焦炭混合高温加热
B. 在氧气流中将Cu2S 充分灼烧转变为CuO
C. 将铝丝插入CuSO4溶液中
D. 向盛有Na2O2 的呼吸面具中吹入CO2 及水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图所示,下列说法不正确的是( )
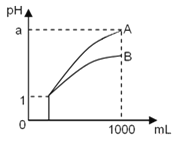
若a<4,则A、B 都是弱酸;
②稀释后,A酸溶液的酸性比B酸溶液强;
③若a=4,则A是强酸,B是弱酸;
④A、B两种酸溶液的物质的量浓度一定相等.
A.①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg—AgCl电池是一种以海水为电解质溶液的水激活电池,电池总反应为Mg+2AgCl===MgCl2+2Ag。下列有关该电池说法错误的是( )
A. 镁为负极 B. AgCl发生了还原反应
C. 电池工作时电能转化为化学能 D. 可用于海上应急照明供电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用11.92gNaClO配成100mL溶液,向其中加入0.01mol Na2Sx恰好完全反应,生成Na2SO4和NaCl。
(1)NaClO溶液的物质的量浓度_________mol·L-1。
(2)化学式Na2Sx中的X=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f、g七种短周期元素在周期表中的位置如图所示。以下说法正确的是( )
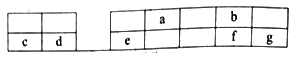
A. a、b、f三种元素的最高价含氧酸均是强酸
B. c、d、e三元素的最高价的水化物均是强碱
C. a、b、f、g四种元素的氢化物的热稳定性逐渐增强
D. e元素的单质既能与氢氧化钠溶液反应,又能与稀硫酸反应且均有氢气放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古代染坊常用某种“碱剂”精炼丝绸,该“碱剂”的主要成分是一种盐,能促进蚕丝表层丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮。这种“碱剂”可能是
A. 食盐 B. 烧碱 C. 草木灰 D. 明矾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com