
| A. | 等浓度的下列溶液①(NH4)2CO3、②(NH4)2SO4、③(NH4)2FeSO4 ④NH3•H2O,NH4+浓度大小顺序: ④>③>②>① | |
| B. | PH值相同的①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中,NH4+浓度大小顺序:③>②>① | |
| C. | 等浓度的①CH3COONH4 ②NH4HCO3 ③(NH4)2CO3PH大小关系:③>②>① | |
| D. | 等浓度等体积NH4Cl与NH3.H2O混合液的物量守恒:c(NH4+)+c(NH3.H2O)=c(Cl-) |
分析 A.物质的量相等的这几种溶液中,NH3•H2O溶液中c(NH4+)小于铵盐的c(NH4+),结合影响铵根离子水解平衡的因素判断;
B.相同pH的(NH4)2SO4与NH4Cl溶液的水解程度,NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制;
C.根据铵根离子与酸根离子的水解程度判断;
D.根据物料守恒分析.
解答 解:A.NH3•H2O溶液中c(NH4+)小于铵盐的c(NH4+),所以一水合氨溶液中铵根离子浓度最小,碳酸根离子促进铵根离子水解,亚铁离子水解产生的氢离子会抑制铵根离子水解,所以NH4+浓度大小顺序:③>②>①>④,故A错误;
B.相同pH的(NH4)2SO4与NH4Cl溶液中,都是强酸弱碱盐,根据溶液呈电中性可判断二者NH4+浓度相等,由于NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,因此NH4HSO4中NH4+的浓度小于(NH4)2SO4,则NH4+浓度大小顺序:①=②>③,故B错误;
C.等浓度的①CH3COONH4 ②NH4HCO3 ③(NH4)2CO3,醋酸根离子与铵根离子的水解程度相同,即CH3COONH4显中性,NH4HCO3 和(NH4)2CO3均显碱性,碳酸根离子的水解程度大于碳酸根离子,(NH4)2CO3溶液的PH大于NH4HCO3,所以PH大小关系:③>②>①,故C正确;
D.等浓度等体积NH4Cl与NH3.H2O混合液中,物料守恒为:c(NH4+)+c(NH3.H2O)=2c(Cl-),故D错误.
故选C.
点评 本题考查离子浓度大小的比较、弱电解质的电离、盐的水解原理的应用,题目难度中等,把握影响铵根离子水解平衡移动的因素为解答的关键,侧重分析与应用能力的考查.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:实验题
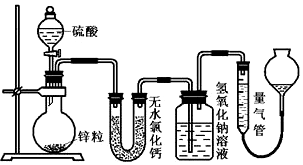
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{32m}{n}$ | B. | $\frac{16m}{n}$ | C. | $\frac{32n}{m}$ | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 | |
| B. | 为防止臭氧空洞的扩大,联合国环保组织要求各国大量减少CO2的工业排放量 | |
| C. | 棉花、蚕丝和锦纶的主要成分都是纤维素 | |
| D. | 为了防止中秋月饼等富含脂食品氧化变质,延长保质期,可以包装袋中放入生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=12的溶液中,Al3+、Cl-、HCO3-、Na+可以大量共存 | |
| B. | 在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存 | |
| C. | 由0.1 mol/L-元碱BOH溶液的pH=10,可推知BOH溶液存在BOH?B++OH- | |
| D. | pH=2的一元酸和pH=12的一元强碱等体积混后溶液一定存在:c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
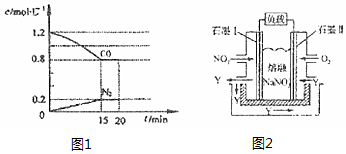
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaHB的存在抑制了水的电离 | |
| B. | HB-水解方程式:HB-+H2O?H3O++B2- | |
| C. | 相同物质的量浓度溶液的pH值:NaHB>Na2B | |
| D. | 溶液中离子浓度大小为:c(Na+)>c(HB-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋可除去热水壶内壁的水垢 | |
| B. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| C. | 利用纳米铁粉的物理吸附作用去除水体中的Gu2+、Hg2+等重金属离子 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com