
【题目】现有下列十种物质:①液态氯化氢;②小苏打;③固体纯碱;④二氧化碳;⑤葡萄糖;⑥氢氧化钾;⑦氢氧化铁胶体;⑧氨水;⑨空气;⑩硫酸铁溶液。
(1)上述十种物质中,属于电解质的___________,属于非电解质的有____________。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H+ + OH- = H2O,该反应的化学方程式为________。
(3)除去③中少量②的操作是___________,化学方程式为__________。
(4)现有10mL⑩溶液中含Fe3+ 5.6g,则溶液中SO42-的物质的量浓度是____________。
(5)若在⑦中缓慢加入①的水溶液,产生的现象是_____________________。
【答案】①②③⑥ ④⑤ HCl + KOH = KCl + H2O 加热 2NaHCO3![]() Na2CO3+CO2↑+H2O 1.5mol/L 先产生红褐色沉淀后沉淀溶解,溶液变黄色
Na2CO3+CO2↑+H2O 1.5mol/L 先产生红褐色沉淀后沉淀溶解,溶液变黄色
【解析】
(1)溶于水或在熔融状态下能够自身电离出离子的化合物是电解质,溶于水和在熔融状态下都不能够自身电离出离子的化合物是非电解质;
(2) H++OH-=H2O是强酸和强碱反应且生成可溶性盐和水的离子方程式;
(3)碳酸氢钠受热易分解生成碳酸钠;
(4)根据硫酸铁的化学式可知硫酸根的物质的量;
(5)胶体中加入电解质,先发生聚沉,再加入电解质HCl, 由于是酸碱中和反应,沉淀又溶解。
(1)溶于水或在熔融状态下能够自身电离出离子的化合物是电解质,因此属于电解质的有液态氯化氢、小苏打、固体纯碱、氢氧化钾;溶于水和在熔融状态下都不能够自身电离出离子的化合物是非电解质,因此属于非电解质的有二氧化碳、蔗糖;
答案为①②③⑥;④⑤;
(2)有两种物质在水溶液中可发生反应,离子方程式为H++OH-=H2O,这说明应该是强酸和强碱反应且生成可溶性盐,则该反应的化学方程式为HCl + KOH = KCl + H2O;
(3)碳酸氢钠受热易分解生成碳酸钠,则除去③中少量②的操作是加热,反应的化学方程式为2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(4) 5.6g铁离子的物质的量是0.1mol,则根据硫酸铁的化学式可知硫酸根的物质的量是0.15mol,浓度是![]() =1.5mol/L;
=1.5mol/L;
(5) 若在⑦氢氧化铁胶体中缓慢加入①液态氯化氢的水溶液,胶体中加入电解质,先发生聚沉,再加入电解质HCl,由于是酸碱中和反应,沉淀又溶解,溶液变为黄色,故答案为:先产生红褐色沉淀后沉淀溶解,溶液变黄色。


科目:高中化学 来源: 题型:
【题目】纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。
(1)工业上“侯氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
生产纯碱的工艺流程示意图如下:
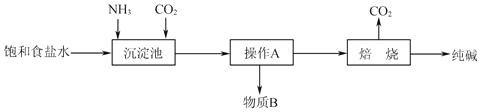
请回答下列问题:
①析出的NaHCO3晶体中可能含有少量氯离子杂质,检验该晶体中是否含有氯离子杂质的操作方法法是__________________。
②该工艺流程中可回收再利用的物质是______________________。
(2)常温下在10ml0.1 mol/L-Na2CO3溶液中逐滴加入0.1mol/L液20mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液pH变化的部分情况如下图所示。
根据图示回答下列问题:
①在同一溶液中,CO32-、HCO3-、H2CO3________(填“能”或“不能”)大量共存。
②在滴加盐酸的过程中HCO3-的物质的量先增加后减少的原因是____________、________________________(请分别用离子方程式表示)。
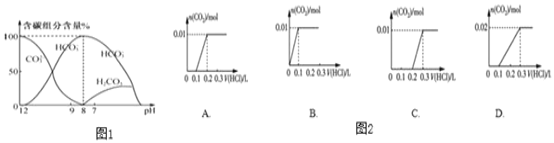
③将0.84g NaHCO3和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.10mol/L稀盐酸。图像能正确表示加积入盐酸的体积和生成CO2的物质的量的关系的是__________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸和醋酸是生产、生活和化学实验中常见的酸。请回答:
(1)人的胃液中含有盐酸,经测定某人胃液的pH为2.0,则其中的c(H+)=___moL。
(2)食醋常用于食品调味,其主要成分为醋酸。醋酸的电离方程式为____。
(3)室温下,pH均为3的盐酸和醋酸溶液,下列各项中相等的是__(填编号)。
①溶液中的c(H+) ②酸的物质的量浓度 ③完全中和时,消耗NaOH的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、 E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
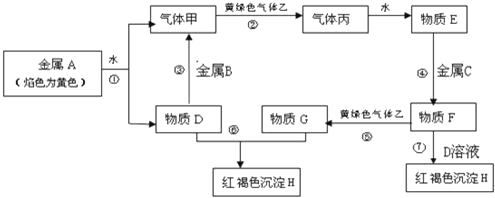
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:B__________、丙__________。
(2)说出黄绿色气体乙的一种用途:________________。反应过程⑦可能观察到的实验现象是________________。
(3)反应①的离子方程式为________________。
(4)反应③中的氧化剂是____________(写化学式,下同)反应④中的还原剂是____________。
(5)写出反应⑤的离子方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图实验装置探究铜丝与过量浓硫酸的反应及SO2的部分化学性质。
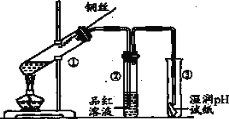
(1)试管①中发生反应的化学反应方程式为_____________________。
(2)装置③证明SO2溶液显__________性,同时证明SO2_________(填“能”或“不能”)漂白pH试纸。
(3)实验完毕,取下试管②并加热,可观察的现象是____________,该实验可以达到的目的是_______。
(4)实验初期发现大试管内有白色沉淀生成,该沉淀的化学式为_____________。
(5)终止试管①中反应的方法是_____________。
(6)基于环境保护的考虑,如图是某学生提出的实验改进方法,其中棉花团上应浸取的试剂为_________(任填一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法中,正确的是( )
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 2-甲基丁烷也称为异丁烷
C. ![]() 和
和![]() 互为同系物
互为同系物
D. CH3CH2CH2CH3光照下与氯气反应,只生成1种一氯代烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14gC2H4含有的单键数目为3NA
B.99℃时,1LpH=6的纯水中,含有的OH-数目为1×10-8NA
C.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
D.100 g CaS与CaSO4的混合物中含有32 g硫,则含有的氧原子数为1.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1) 200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。(2) 向(1)的滤液中加入足量的NaOH溶液,加热,标准状况下产生能使湿润红色石蕊试纸变蓝的气体1.12 L。由此可以得出关于原溶液组成的正确结论是
A. 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+
B. 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+
C. c(CO32-)=0.01mol·L-1,c(NH4+)>c(SO42-)
D. 如果上述6种离子都存在,则c(Cl-)>c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示,则下列说法不正确的是( )
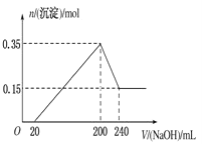
A.镁和铝的总质量为9g
B.最初20mLNaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.0molL1
D.生成的氢气在标准状况下的体积为10.08L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com