
| A. | 原子半径 A>B>D>C | |
| B. | 原子序数 d>c>b>a | |
| C. | 离子半径 C>D>B>A | |
| D. | 原子结构的最外层电子数目 A>B>D>C |
分析 短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,核外电子数相等,所以有:a-2=b-1=c+3=d+1,原子序数:a>b>d>c,C、D为非金属,应处于第二周期,A、B为金属应处于第三周期,结合离子电荷可知,A为Mg元素,B为Na元素,故C为N素,D为F元素,结合元素周期律递变规律解答该题
解答 解:短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,核外电子数相等,所以有:a-2=b-1=c+3=d+1,原子序数:a>b>d>c,C、D为非金属,应处于第二周期,A、B为金属应处于第三周期,结合离子电荷可知,A为Mg元素,B为Na元素,故C为N素,D为F元素,
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>Mg>N>F,故A错误;
B.由以上分析可知,原子序数:a>b>d>c,故B错误;
C.aA2+、bB+、cC3-、dD-具有相同电子层结构,核电荷数越大离子半径越小,核电荷数a>b>d>c,所以离子半径:C>D>B>A,故C正确;
D.A为Mg元素,B为Na元素,故C为N素,D为F元素,最外层电子数依次为2、1、5、7,最外层电子数目D>C>A>B,故D错误,
故选C.
点评 本题考查位置结构性质的相互关系及应用,根据短周期元素离子核外电子层结构相同及离子所带电荷确定元素,注意把握元素周期律的递变规律进行解答,题目难度中等.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案科目:高中化学 来源: 题型:解答题
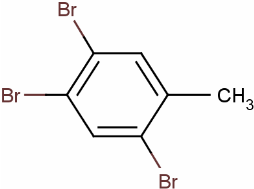 +3HBr.
+3HBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||
| X | Y | Z |
| A. | X的氢化物比R的氢化物稳定 | |
| B. | 原子半径大小顺序是Z>Y>X>R | |
| C. | Z的单质能与Y的某些化合物发生置换反应 | |
| D. | R的最高价氧化物对应水化物分子为HRO3或H3RO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始加入合金的总物质的量为0.15mol | |
| B. | 生成NO气体体积在标准状况下为2.24L | |
| C. | 生成沉淀完全时消耗NaOH溶液体积为100mL | |
| D. | 原硝酸物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 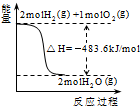 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ•mol-1 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ•mol-1 | |
| B. | 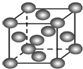 表示Cu形成金属晶体时的堆积方式 表示Cu形成金属晶体时的堆积方式 | |
| C. | 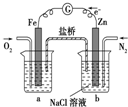 装置中烧杯a中的溶液pH降低 装置中烧杯a中的溶液pH降低 | |
| D. |  装置中待镀铁制品应与电源正极相连 装置中待镀铁制品应与电源正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| CO | H2O | H2 | CO | ||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 |
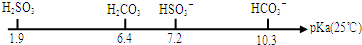
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com