
【题目】下列分子或离子中,VSEPR(价层电子对互斥理论)模型名称与分子或离子的空间构型名称不一致的是
A.CO2B.CO32-C.H2OD.CC14
【答案】C
【解析】
A. CO2分子中每个O原子和C原子形成两个共用电子对,所以C原子价层电子对个数是2,且不含孤电子对,为直线形结构,VSEPR模型与分子立体结构模型一致,A不符合题意;
B. CO32-的中心原子C原子上含有3个σ键,中心原子上的孤电子对数=![]() ×(4+2-2×3)=0,所以CO32-的空间构型是平面三角形,VSEPR模型与分子立体结构模型一致,B不符合题意;
×(4+2-2×3)=0,所以CO32-的空间构型是平面三角形,VSEPR模型与分子立体结构模型一致,B不符合题意;
C. H2O分子中价层电子对个数=2+![]() ×(6-2×1)=4,VSEPR模型为正四面体结构;含有2个孤电子对,去掉孤电子对后,实际上其空间构型是V型,VSEPR模型与分子立体结构模型不一致,C符合题意;
×(6-2×1)=4,VSEPR模型为正四面体结构;含有2个孤电子对,去掉孤电子对后,实际上其空间构型是V型,VSEPR模型与分子立体结构模型不一致,C符合题意;
D. CCl4分子中中心原子C原子原子价层电子对个数=σ键个数+孤电子对个数=4+![]() ×(4-1×4) =4,VSEPR模型为正四面体结构,中心原子不含有孤电子对,分子构型为正四面体结构,VSEPR模型与分子立体结构模型一致,D不符合题意;
×(4-1×4) =4,VSEPR模型为正四面体结构,中心原子不含有孤电子对,分子构型为正四面体结构,VSEPR模型与分子立体结构模型一致,D不符合题意;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】2020年1月南开大学周其林团队因《高效手性螺环催化剂的发现》获得国家自然科学一等奖。下面为两种简单碳螺环化合物,相关的说法正确的是

A.上述两种物质中所有碳原子处于同一平面
B.螺[3,3]庚烷的一氯代物有2种
C.螺[3,4]辛烷与3-甲基-1-庚烯互为同分异构体
D.![]() 的名称为螺[5,4]壬烷
的名称为螺[5,4]壬烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化锡可用于染料、香料、制镜、电镀等工业,是一种重要的化工原料。实验室制备二氯化锡可分三个过程完成,具体实验如下:
已知:①常温下四氯化锡是无色易流动的液体,熔点-33℃,沸点114.1℃,易溶于水。
②二氯化锡:遇水强烈水解,在浓盐酸中溶解度大且有利于SnCl2·2H2O的生成。
I.四氯化锡的制备。所需装置如图所示:
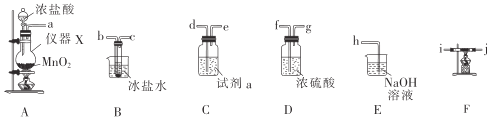
(1)仪器X的名称是___。
(2)试剂a是___,冰盐水的作用是__。
(3)按气流从左到右的顺序连接好装置:a___。
II.SnCl2·2H2O的制备
将装置B中得到的无色液体全部倒入锥形瓶中并加入适量浓盐酸,慢慢加入锡粉直至不能溶解,过滤后即得到SnCl2·2H2O。
(4)加入适量浓盐酸的作用是___。
(5)加入锡粉发生的反应为___。
III.SnCl2·2H2O的脱水,步骤如下:
a.将得到的SnCl2·2H2O置于干燥的50mL烧杯中,加入足量醋酸酐(CH3COOOCCH3)溶解。
b.将烧杯放入通风橱内,约5分钟搅拌一次,30分钟后在干燥的布氏漏斗上过滤。
c.用3~5mL乙醚淋洗产品,将产品转移至表面血,放入干燥器中干燥30分钟后,称重。
(6)SnCl2·2H2O脱水步骤a中加入醋酸酐后得到的有机物的结构简式是___。
(7)设计实验检测制得的SnCl2中是否有SnCl4:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作燃料。
I.工业上利用CO生产燃料甲醇。已知2H2(g)+CO(g) CH3OH(g),则:
(1)在恒温恒容的刚性容器中进行该反应,能说明达到平衡状态的是____。(选填字母序号)
a.混合气体密度不再改变
b.混合气体平均摩尔质量不再改变
c.H2、CO、CH3OH的浓度之比为2:1:1
d.单位时间内消耗1molCO的同时生成2molH2
(2)在密闭容器中按物质的量之比为2:1充入H2和CO,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示。
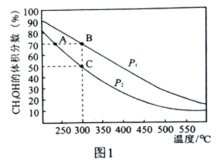
①逆反应速率:v逆(A)__v正(B)(填“>”、“<”或"=”)
②C点时,H2的平衡转化率为________________,该反应的平衡常数Kp=____kPa-2(用含p2的代数式表达,KP为用气体平衡分压代替气体平衡浓度表示的平衡常数,气体分压=气体总压×气体的物质的量分数)。
II.甲醇水蒸气重整制氢(SRM)系统简单,产物中H2含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池的理想氢源。反应如下:
反应i(主):CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H1=+49kJ·mol-1
反应ii(副):H2(g)+CO2(g) CO(g)+H2O(g) △H2=+41kJ·mol-1
温度高于300°C则会同时发生反应iii:CH3OH(g) CO(g)+2H2(g) △H3
(3)计算△H3=____________.
(4)升温将有利于提高CH3OH转化率,但也存在一个明显的缺点是____________。
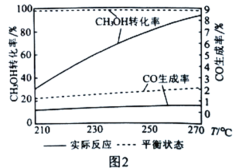
(5)催化剂可以改变化学反应速率,但也存在着一种特性叫“催化剂的选择性”。图2为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。随着温度的升高,CO的实际反应生成率与平衡状态生成率相差越来越大的原因是催化剂对____________(填“反应i”或"反应ii”)的选择性低。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3与NaHCO3的性质判断正确的是( )
A.常温下溶解度:Na2CO3<NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3
D.与澄清石灰水反应,均有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.氢气用于工业合成氨 N2(g) + 3H2(g) ![]() 2NH3(g);ΔH = -92.2 kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t5 ﹑t7时刻所对应的实验条件改变分别是
2NH3(g);ΔH = -92.2 kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t5 ﹑t7时刻所对应的实验条件改变分别是
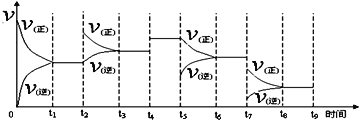
t5 ___________________。t7___________________。
Ⅱ.已知化学反应①:Fe(s)+CO2(g) ![]() FeO(s)+CO(g), 其平衡常数为K1;
FeO(s)+CO(g), 其平衡常数为K1;
化学反应②:Fe(s)+H2O(g) ![]() FeO(s)+H2(g),其平衡常数为K2。
FeO(s)+H2(g),其平衡常数为K2。
在温度973K和1173K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)1173K时,若c(CO2)=2mol/L,c(CO) =5mol/L,则此时反应①平衡向__________(填“正”或“逆”)反应方向移动。
(2)现有反应③CO2(g)+H2(g) ![]() CO(g)+H2O(g),写出该反应的平衡常数K3的表达式:K3=_______________________(用K1 、 K2表示)。据此关系式及上表数据,能推断出反应③是______(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是______(填写序号)。
CO(g)+H2O(g),写出该反应的平衡常数K3的表达式:K3=_______________________(用K1 、 K2表示)。据此关系式及上表数据,能推断出反应③是______(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是______(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
能判断反应③已达平衡状态的是_______________________________。
A.恒容容器中压强不变 B.混合气体中c(CO)不变
C.![]() (H2)==
(H2)==![]() (H2O) D.c(CO2)==c(CO)
(H2O) D.c(CO2)==c(CO)
(3)723K时,0.2molCO2和0.1molH2通入抽空的1L恒容密闭容器中,发生反应③,达到平衡后水的物质的量分数为0.1。则H2的转化率α(H2)=___________%。723K该反应的平衡常数为K=________________。(结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O5可用作食品的抗氧化剂。为测定某葡萄酒中Na2S2O5残留量,取50.00 mL葡萄酒样品,用0.01000 mol·L1的碘的水溶液与其反应,恰好消耗10.00 mL。下列说法正确的是( )
A.反应的离子方程式为:S2O52- + I2 + 3H2O = 2SO42- + 2I-+ 6H+
B.该反应转移电子数为1×10-3NA
C.该样品中Na2S2O5的残留量,若以SO2计为0.128 g·L1
D.反应结束后,所得溶液的pH比原溶液增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国研究人员结合实验与计算机模拟结果,揭示了在金催化剂表面上水煤气变换的反应历程(如图所示),其中吸附在金催化剂表面上的物质用·标注。下列说法正确的是
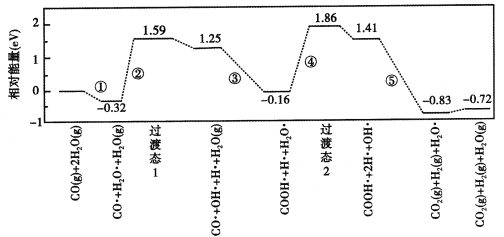
A.水煤气变换反应的△H<0
B.该历程中最大能垒(活化能)E正=1.70 eV
C.步骤⑤只有H-H键和H-O键形成
D.步骤③的转化关系可表示为:CO·+OH·+H2O(g)=COOH·+H2O·
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某致病细菌分泌的外毒素,无色,细针状结晶,对小鼠和人体有很强的毒性,可引起流涎、呕吐、便血、痉挛等,以致死亡。该外毒素为环状肽,结构式如图所示,请据图分析回答:

(1)该化合物中含有游离的氨基_____________个,羧基________________个。
(2)该化合物是由_____________个氨基酸组成的,区别这些氨基酸的种类是依靠其结构中的_____________。
(3)组成该化合物的氨基酸有___________种,其中有_____________个氨基酸的R基相同,这个R基是_______________。
(4)该化合物称为环状__________肽化合物,含有___________个肽键。
(5)填写虚线框内结构的名称:A._________________,B.___________________。
(6)该化合物具有8个氮原子,其中_____________个位于肽键上,____________个位于R基上。
(7)该外毒素环肽在形成过程中失去了______________个水分子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com