
分析 (1)SO2气体通入甲酸钠的碱性溶液可以生成Na2S2O4,根据元素守恒和电子得失守恒写化学方程式;
(2)根据电子得失守恒可知,保险粉与重铬酸根离子反应的关系式为Cr2O72-~Na2S2O4,据此计算;
(3)①Na2S2O4溶液在空气中易被氧化生成亚硫酸氢钠,结合电荷守恒和原子守恒书写离子方程式;
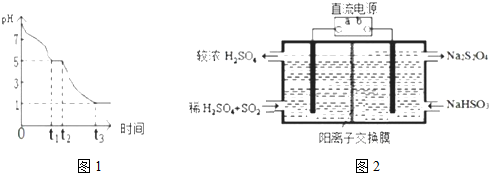
②t3时溶液的pH=1,说明溶液的酸性较强,因此亚硫酸氢钠被氧化为硫酸氢钠;t2-t3阶段pH变小是氢离子浓度增大,说明是亚硫酸氢根离子被氧化为硫酸;
③若t1时溶液中Na2S2O4全部被氧化成NaHSO3,溶液中电荷守恒和物料守恒计算得到;
(4)①NaHSO3转化为Na2S2O4,元素化合价降低,亚硫酸氢钠做氧化剂得到电子发生还原反应,b电极为电源的负极,亚硫酸氢钠变化为硫酸,元素化合价升高失电子发生氧化反应,则a电极为电源的正极,
②阴极是亚硫酸氢钠被还原为Na2S2O4,结合电荷守恒和原子守恒分析书写电极反应;
解答 解:(1)SO2气体通入甲酸钠的碱性溶液可以生成Na2S2O4,反应的化学方程式为:2NaOH+HCOOH+2SO2=Na2S2O4+CO2+2H2O,
故答案为:2NaOH+HCOOH+2SO2=Na2S2O4+CO2+2H2O;
(2)根据电子得失守恒可知,保险粉与重铬酸根离子反应的关系式为Cr2O72-~Na2S2O4,所以每消耗0.2mol保险粉,理论上可以除去Cr2O72-的物质的量为0.2mol,
故答案为:0.2;
(3)①Na2S2O4溶液在空气中易被氧化生成亚硫酸氢钠,则0~t1段发生离子反应方程式为:2S2O42-+O2+2H2O=4HSO3-.
故答案为:2S2O42-+O2+2H2O=4HSO3-;
②t3时溶液的pH=1,说明溶液的酸性较强,因此亚硫酸氢钠被氧化为硫酸氢钠,则溶液中主要阴离子符号是SO42-,
故答案为:SO42-;
③若t1时溶液中Na2S2O4全部被氧化成NaHSO3,溶液中电荷守恒为:c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),物料守恒为:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),带入计算得到c(SO32-)-c(H2SO3)=c(H+)-c(OH-)=10-5-10-9,
故答案为:10-5-10-9;
(4)①NaHSO3转化为Na2S2O4,元素化合价降低,亚硫酸氢钠做氧化剂得到电子发生还原反应,b电极为电源的负极,亚硫酸氢钠变化为硫酸,元素化合价升高失电子发生氧化反应,则a电极为电源的正极,
故答案为:正极;
②阴极是亚硫酸氢钠在酸性溶液中被还原为Na2S2O4,结合电荷守恒和原子守恒分析书写电极反应为:2HSO3-+2H++2e-=S2O42-+2H2O
故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;
点评 本题考查氧化还原反应、水解反应、物质制备和检验实验设计与探究,涉及对反应原理、装置及操作的分析评价、离子方程式的书写等,注意对物质性质信息的应用,难度中等.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图
)可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图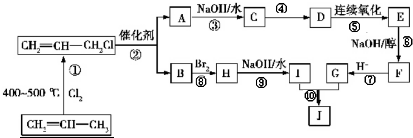
 +3NaOH$→_{△}^{乙醇}$ NaOOC-CH=CH-COONa+NaCl+3H2O;
+3NaOH$→_{△}^{乙醇}$ NaOOC-CH=CH-COONa+NaCl+3H2O;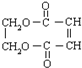 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
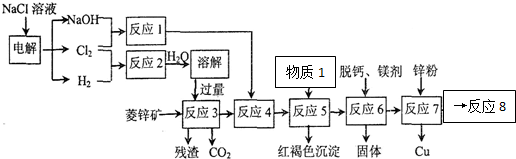
| 离子 | 开始沉淀时的PH | 完全沉淀时的PH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.5 | 9.7 |
| Zn2+ | 6.4 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
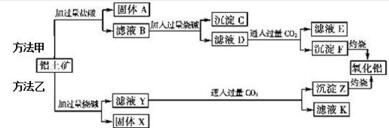
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题:
氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能发生丁达尔现象 | |
| B. | 胶体粒子能通过滤纸空隙 | |
| C. | 胶体在一定条件下能稳定存在 | |
| D. | 胶体分散质粒子直径在1nm~100nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
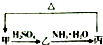 甲、乙、丙三种物质之间有如下转化关系(如图):
甲、乙、丙三种物质之间有如下转化关系(如图):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com