
| A. | 其单质的熔点比钠的熔点低 | B. | 在空气中燃烧只能生成Fr2O | ||
| C. | 其原子半径在同一主族中是最大的 | D. | 氧化物对应的水化物的碱性很强 |
分析 Fr属于碱金属元素,位于第七周期,根据同主族元素性质的相似性和递变性,钠和钫位于周期表相同主族,钫的原子半径大,金属性较强,熔点较低,以此解答该题.
解答 解:A.原子半径逐渐增大,则金属键逐渐减弱,钫的熔点较低,故A正确;
B.在碱金属元素中只有Li生成Li2O,其它元素对应的单质能生成氧化物、过氧化物、超氧化物等,故B错误;
C.同主族元素从上到下原子半径逐渐增大,则Fr在碱金属元素中具有最大的原子半径,故C正确;
D.Fr在碱金属中元素的金属性最强,对应的氧化物的水化物的碱性极强,故D正确;
故选B.
点评 本题考查同主族元素的性质的递变规律,为高频考点,侧重于学生的分析能力的考查,注意把握元素的性质与对应单质、化合物的性质的递变性和相似性的判断,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 开始时观察到金属碎片表面有极少量气泡,可能原因为该金属片表面有氧化膜 | |
| B. | 过程中观察到金属碎片表面有大量气泡并在液面上“翻滚”,说明该合金碎片的密度小于该盐酸溶液的密度 | |
| C. | 该盐酸的物质的量浓度一定为4.0 mol•L-1 | |
| D. | 溶液X中Mg2+与Al3+的物质的量之比一定为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有元素原子的最外层电子数都等于元素的最高化合价 | |
| B. | P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次减弱 | |
| C. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| D. | 熔融状态能导电的化合物一定含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Cl2(g)═2HCl(g)△H=-184.6 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3 kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | C(s)+O2(g)═CO2(g)△H=-285.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
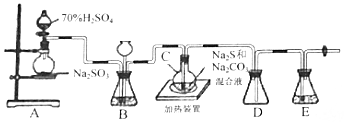
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子).下列说法正确的是( )
厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子).下列说法正确的是( )| A. | 通电后,阳极附近pH增大 | |
| B. | 电子从负极经电解质溶液回到正极 | |
| C. | 通电后,A-通过阴离子交换膜从阴极进入浓缩室 | |
| D. | 当电路中通过2mol电子的电量时,会有1mol的O2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  2-乙基丁烷 2-乙基丁烷 | B. | CH3CHBr2 二溴乙烷 | ||
| C. | 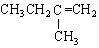 2-甲基丁烯 2-甲基丁烯 | D. | 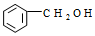 苯甲醇 苯甲醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com