
【题目】Y是合成药物查尔酮类抑制剂的中间体,可由X在一定条件下反应制得。下列叙述正确的是( )
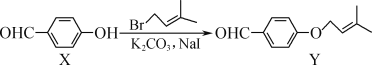
A.Y的分子式为C12H14O2
B.可用FeCl3溶液鉴别X和Y
C.Y能使酸性高锰酸钾溶液褪色可证明其分子中含有碳碳双键
D.1molX与4molH2完全加成所得产物分子中含2个手性碳原子
科目:高中化学 来源: 题型:
【题目】图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
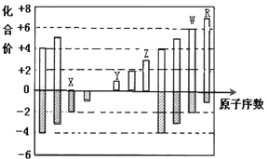
A. 原子半径:Z>Y>X
B. Y和Z两者最高价氧化物对应水化物能相互反应
C. WX3和水反应形成的化合物是离子化合物
D. 气态氢化物的稳定性:R<W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在图1所示的半径相等的圆球的排列中,A属于________层,配位数是________;B属于________层,配位数是________。
(2)将非密置层一层一层地在三维空间里堆积,得到如图2所示的一种金属晶体的晶胞,它被称为简单立方堆积,在这种晶体中,金属原子的配位数是________,平均每个晶胞所占有的原子数目是________。

(3)有资料表明,只有钋的晶体中的原子具有如图2所示的堆积方式,钋位于元素周期表的第________周期第__________族,元素符号是________,最外电子层的电子排布式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NaOH溶液捕获CO2。向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL。在稀释后的溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.
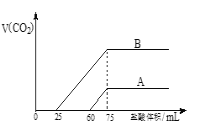
(1)曲线B表明原溶液中通入CO2后,所得溶液中的溶质为(写化学式)_____________,其物质的量之比为__________________。当耗盐酸0<v(HCl)<25 mL时发生的离子反应为:____________。
(2)曲线A表明,最初通入的CO2在标准状况下的体积为_________mL。
(3)通过计算求出原NaOH溶液的物质的量浓度______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在古代,我国人民就积累了不少对化学物质变化的认识。例如,晋代炼丹家、医学家葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这句话中的丹砂指的是HgS,下列有关说法正确的是( )
A.这个过程只涉及物理变化
B.“积变又还成丹砂”过程中发生反应:HgS![]() Hg+S
Hg+S
C.实验室中不慎洒落的水银不能用硫黄处理
D.“丹砂烧之成水银”过程中还可能产生SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 298 K时,2H2S(g)+SO2(g)===3S(s)+2H2O(l)能自发进行,则其ΔH>0
B. 氨水稀释后,溶液中c(NH4+)/c(NH3·H2O)的值减小
C. 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等
D. 25℃时Ka(HClO)=3.0×108,Ka(HCN)=4.9×1010,若该温度下NaClO溶液与NaCN溶液的pH相同,则c(NaClO)>c(NaCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室测定铬铁矿中铬(Cr)含量的步骤如下:
步骤1:准确称取0.2000g铬铁矿试样放入锥形瓶中,加入适量磷酸和硫酸的混合酸,加热使试样完全溶解,冷却。
步骤2:向上述溶液中滴加5滴1%MnSO4溶液,再加入一定量的(NH4)2S2O8溶液,摇匀至溶液呈紫红色[先后发生Cr3+![]() Cr2O72-、Mn2+
Cr2O72-、Mn2+![]() MnO4-]。
MnO4-]。
步骤3:上述溶液加热煮沸至紫红色褪去[除去过量的(NH4)2S2O8和生成的MnO4-],冷却。
步骤4:用0.2000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定上述溶液至终点(发生Cr2O72-![]() Cr3+),消耗19.50mL标准溶液。
Cr3+),消耗19.50mL标准溶液。
(1)(NH4)2S2O8中阴离子的结构如图所示。从结构分析,(NH4)2S2O8置于棕色试剂瓶并于阴凉处保存的原因是__。
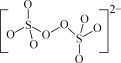
(2)“步骤2”中加入5滴1%MnSO4溶液的目的是__。
(3)“步骤3”中,如果继续加热煮沸时间不充足,会使铬含量的测定结果___(填“偏大”“不变”或“偏小”)。
(4)计算铬铁矿中铬的质量分数___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴的流程如下:
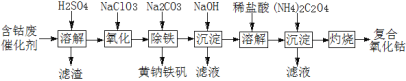
(1)用H2SO4溶解后过滤,得到的滤渣是____(填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是____。
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是____。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3 =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4 =Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是____。(仅供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(4)向氧化后的溶液中加入适量的Na2CO3调节酸度,使之生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的离子方程式:____。
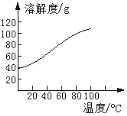
(5)已知CoCl2的溶解度曲线如图所示。向碱式碳酸钴沉淀中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 ____________晶体;基态Ni原子的电子排布式为 _______________;
写出两种与配体CO互为等电子体微粒的化学式_____________、________________ 。
(2)某镍配合物结构如图所示,分子内含有的作用力有____________(填序号)。
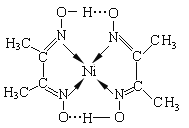
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应,
如①CH2=CH2、②HC ≡ CH、③ ![]() ④HCHO等,其中碳原子采取sp2杂化的分子有_________(填序号);HCHO分子的空间构型为:__________。
④HCHO等,其中碳原子采取sp2杂化的分子有_________(填序号);HCHO分子的空间构型为:__________。
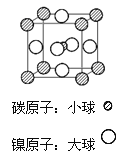
(4)据报道,某种含有镁、镍和碳三种元素的晶体具有超导性,其结构如图所示。则该晶体的化学式为__________ 。晶体中每个镁原子周围距离最近的镍原子有 _________个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com