
| A. | 熔点:石英>食盐>冰>干冰 | |
| B. | 结合质子(H+)能力:OH->HCO-3>CH3COO- | |
| C. | 离子半径:S2->Cl->Al3+>O2- | |
| D. | 热稳定性:HF>HCl>H2S>PH3 |
分析 A、熔点:原子晶体>离子晶体>分子晶体;
B、对应酸的酸性越弱,则离子结合氢的能力越强;
C、电子层结构相同,核电荷数越大,离子半径越小;电子层越多,离子半径越大;
D、非金属性越强,对应气态氢化物越稳定.
解答 解:A、熔点:原子晶体>离子晶体>分子晶体,冰的熔点高于干冰,即石英>食盐>冰>干冰,故A正确;
B、酸性:H2O<H2CO3<CH3COOH,酸性越强,对应的阴离子结合质子的能力越弱,结合质子(H+)能力:OH->HCO-3>CH3COO-,故B正确;
C、电子层结构相同,核电荷数越大,离子半径越小,所以离子半径:O2->Al3+、S2->Cl-,最外层电子数相同,电子层越多,离子半径越大,所以离子半径:Cl->O2-,所以离子半径:S2->Cl->O2->Al3+,故C错误;
D、非金属性:F>Cl>S>P,对应气态氢化物为:HF>HCl>H2S>PH3,故D正确.
故选C.
点评 本题考查元素周期表与周期律的递变性,明确同周期、同主族元素的性质变化规律及元素非金属性的比较方法是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 香蕉、苹果等食物存放在冰箱里 | |
| B. | 服用钙片要充分咀嚼后再吞服 | |
| C. | 用铁桶(或铝桶)存放浓硫酸 | |
| D. | 我国在西周时期发明的“酒曲”酿酒工艺 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提出原子结构模型的科学家按时间先后依次是:道尔顿、汤姆生、卢瑟福、玻尔 | |
| B. | 已知PM2.5是指大气中直径≤2.5×10-6m的颗粒物,则受PM2.5污染的大气不一定能产生丁达尔现象 | |
| C. | 借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素 | |
| D. | 并不是所有金属元素都可以用焰色反应来确定其存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .其中心原子的杂化类型为sp3.
.其中心原子的杂化类型为sp3. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{N}{V}$ mol•L-1 | B. | $\frac{2N}{3V}$ mol•L-1 | C. | $\frac{N}{2V}$ mol•L-1 | D. | $\frac{3N}{2V}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
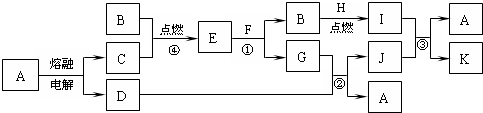
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com