
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关叙述正确的是

A. 随pH增大,![]() 数值先减小后增大
数值先减小后增大
B. b点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)+c(HCO3- )
C. 25℃时,碳酸的第一步电离常数Ka1=10-7
D. 溶液呈中性时:c(HCO3- )>c(CO32-)>c(H2CO3)
【答案】B
【解析】A. 0.1 mol Na2CO3与盐酸混合,随pH增大,根据图像,随pH增大,在溶液中出现碳酸根离子后,c(CO32-)增大,c(HCO3- )减小,因此![]() 数值增大,故A错误;B. b点所示的溶液中c(CO32-)=c(HCO3- ),根据电荷守恒,c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)+c(HCO3- ),故B正确;C.根据图像,pH=6时,c(HCO3- )=c(H2CO3) ,则25℃时,碳酸的第一步电离常数Ka1=
数值增大,故A错误;B. b点所示的溶液中c(CO32-)=c(HCO3- ),根据电荷守恒,c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)+c(HCO3- ),故B正确;C.根据图像,pH=6时,c(HCO3- )=c(H2CO3) ,则25℃时,碳酸的第一步电离常数Ka1= = c(H+)=10-7,故C错误;D. 溶液呈中性时pH=7,根据图像,c(HCO3- ) >c(H2CO3) >c(CO32-),故D错误;故选B。
= c(H+)=10-7,故C错误;D. 溶液呈中性时pH=7,根据图像,c(HCO3- ) >c(H2CO3) >c(CO32-),故D错误;故选B。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】碱式氯化镁(MgOHCl)常用作塑料添加剂,我国首创利用氢氧化镁与氯化铵热分解制氨气并得到碱式氯化镁的工艺。某科研小组根据该原理设计了如图实验装置制备碱式氧化镁并探究氨的还原性,反应前,装置C中CuO的质量为14.40g。
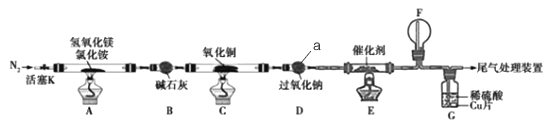
请回答下列问题:
(1)仪器a的名称是_______.
(2)装置A中发生反应的化学方程式为____________,装置B的作用是_________,装置D的作用是________
(3)装置G中的现象为____________
(4)反应结束后装置C中的氧化铜完全反应生成红色固体,并测得其质量为12.24g。则红色固体是______(填化学式),该反应中转移电子的物质的量为_______mol.
(5)完成下列实验方案,证明装置C中完全反应后得到的红色固体中含有氧化亚铜(供选择的试剂:2mol/L的HNO3溶液、2mol/L的H2SO4溶液、2mol/L的NaOH溶液)。
已知:Cu2O+2H+=Cu2++Cu+H2O.
实验步骤 | 预期现象和结论 |
步骤1取装置C中所得红色固体于大试管中 | ----- |
步骤2:_____________________________ | _______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA为阿伏加德罗常数的数值.下列说法正确的是
A. 标准状况下, 78g 苯中含有碳碳双键的数目是 3 NA
B. 18g D2O 含有 10NA个质子
C. 28 g 聚乙烯中含有的原子数目为 6NA
D. 56g 铁片投入足量浓 H2SO4中生成 NA个 SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应,xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.40 mol·L-1,保持温度不变,将容器的容积缩小为原来的一半,再达平衡时,测得A的浓度升高为0.70 mol·L-1。下列有关判断正确的是( )
zC(g),平衡时测得A的浓度为0.40 mol·L-1,保持温度不变,将容器的容积缩小为原来的一半,再达平衡时,测得A的浓度升高为0.70 mol·L-1。下列有关判断正确的是( )
A. x+y>z B. 平衡向逆反应方向移动
C. B的转化率减小 D. C的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于乙烯和乙烷的说法中,不正确的是
A.乙烯属于不饱和烃,乙烷属于饱和烃
B.乙烯中所有原子处于同一平面,乙烷中原子不在同一平面
C.乙烯分子中的碳碳双键比乙烷中碳碳单键更稳定,不易发生化学反应
D.都可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宇宙飞船上常使用氢氧燃料电池,其电极总反应式为:2H2+O2=2H2O;若电解质溶液为KOH溶液,则下列叙述正确的是:
A. 此电池能见到浅蓝色火焰 B. H2为正极,O2为负极
C. 工作时电解液中OH-的物质的量不断增加 D. 电极反应中: H2失电子; O2得电子
【答案】D
【解析】A.该电池中氢气不燃烧,所以不能见到浅蓝色火焰,A错误;B.该原电池中,负极上通入氢气,正极上通入氧气,B错误;C.电池反应式为:2H2+O2=2H2O,根据方程式知,电解质溶液中氢氧根离子的物质的量不变,C错误;D.负极上电极反应式为:2H2+4OH--4e-=4H2O,正极上电极反应式为:O2+2H2O+4e-=4OH-,所以负极上氢气失电子,正极上氧气得电子,D正确;答案选D。
点睛:本题考查燃料电池,明确正负极上得失电子是解本题关键,难点是电极反应式的书写,电极反应式的书写要结合电解质溶液的酸碱性,有时还需要考虑交换膜以及是不是熔融的电解质等。
【题型】单选题
【结束】
21
【题目】可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是 ( )
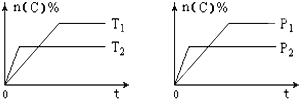
A. P1 > P2
B. 该反应的ΔH < 0
C. 化学方程式系数a>c+d
D. 使用催化剂,C的物质的量分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各小题
(1)写出NaHSO4在水溶液中的电离方程式______________________________________。
(2)氯化铝的水溶液常温时呈_____(填“酸”、“中”、“碱”)性,把氯化铝溶液蒸干,灼烧,最后得到的固体产物是__________。
(3)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是___________________(用离子方程式和适当文字说明);配制完毕后要加入少量铁屑,其目的是____________________________。
(4)t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=________________;
②在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保持温度不变,用惰性电极电解足量饱和的Na2CO3溶液,一段时间后下列叙述正确的是( )
A.Na2CO3溶液的碱性增强
B.阳极反应:CO32--2e-+H2O = CO2↑+2OH-
C.溶液中CO32-+H2O ![]() HCO3-+OH-平衡不移动
HCO3-+OH-平衡不移动
D.向溶液中加入一定量HCOOH的能复原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如图所示的微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是

A. 断开K2,闭合K1时,总反应的离子方程式为:2H+ + 2Cl-![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应为: Cl2+2e-=2Cl-
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com