
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1:1
D.X2Y可能是离子化合物,也可能是共价化合物
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性
D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,有关说法正确的是( )
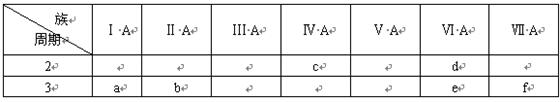
A.e的氢化物比d的氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,c元素单质的化学性质最活泼
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请回答有关问题:
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | | ⑩ |
(1)⑤和⑧的元素符号是 和  ;
;
(2)表中最活泼的金属是 ,非金属最强的元素是 ;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是 ,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式: , ;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有________种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为______________。在GaN晶体中,每个Ga原子与__________个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为________。在四大晶体类型中,GaN属于_______晶体。
(3)在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.同一主族的元素,原子半径越大,其单质的熔点一定越高
B.同一周期元素的原子,半径越小越容易失去电子
C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D.稀有气体元素的原子序数越大,其单质的沸点一定越高
查看答案和解析>>
科目:高中化学 来源: 题型:
A题适用于二期课改新教材,B题适用于一期课改教材。
(A)

(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可把氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的 族。
(3)现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应显黄色。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
② 甲元素与硫元素相比较,非金属性较强的是 (填名称),
写出可以验证该结论的一个化学反应方程式
(B)

(1)在上面元素周期表中全部是金属元素的区域为
(a) A (b) B (c) C (d) D
(2)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是 。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
② 甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
非金属元素A离子与金属元素B的离子具有相同电子层结构,原子半径B>A,它们可形成离子化合物B2A,由此下列正确判断是
A.A可能在第三周期ⅥA族
B.B+离子半径大于A2-离子半径
C.A的电负性小于B的电负性
D.A的第一电离能小于B的第一电离能
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A、足量的CO2通入饱和碳酸钠溶液中: CO2+CO32-+H2O==2HCO3-
B、FeSO4溶液在空气中变质:4Fe2++O2+2H2O==4Fe3++4OH-
C、次氯酸钙溶液中通入足量二氧化硫:Ca2++ClO-+SO2+H2O==CaSO4↓+Cl-+2H+
D、碳酸氢镁溶液中加入过量石灰水
Mg2++2HCO3-+2Ca2++4OH— ==2CaCO3↓+ Mg(OH)2↓+ 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com