
| A. | 0.05mol•L-1 | B. | 0.30 mol•L-1 | C. | 0.15 mol•L-1 | D. | 0.5 mol•L-1 |
科目:高中化学 来源: 题型:选择题
| A. | 胶体不均一、不稳定,静置后易产生沉淀,溶液均一、稳定、静置不产生沉淀 | |
| B. | 溶液和胶体都是纯净物,浊液是混合物 | |
| C. | 光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 | |
| D. | 只有胶状物如胶水、果冻类的物质才能称为胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质不是电解质就是非电解质 | |
| B. | 酸性氧化物不一定都是非金属氧化物,而非金属氧化物一定是酸性氧化物 | |
| C. | 能导电的物质不一定是电解质,电解质不一定能导电 | |
| D. | 液氨溶于水能导电,所以是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精受热变为气体 | B. | 氯化铵受热变为气体 | ||
| C. | 二氧化硅受热熔化 | D. | 食盐溶解在水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称40.0 g 氢氧化钠固体解于1L水中配成1L的氢氧化钠溶液 | |
| B. | 常温常压下将22.4L氯化氢气体溶于水配成1L的盐酸溶液 | |
| C. | 将1L 10mol/L的浓盐酸与水混合配成10L溶液 | |
| D. | 从1000mL 2mol/L NaCl溶液中取出500mL的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 回收废弃的饮料包装纸,制作成公园内的休闲长椅 | |
| B. | 大力开发丰富的煤炭资源,减少对石油的依赖 | |
| C. | 在西部和沿海地区兴建风力发电站,解决能源问题 | |
| D. | 鼓励购买小排量汽车,推广电动、混合动力汽车 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
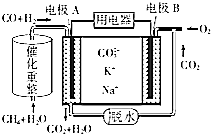 CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)?CO(g)+3H2(g).
CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)?CO(g)+3H2(g).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).
(1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).| 次数编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com