
���dz���NH4Cl��Һ������NaNO2�ķ�Һ��ʹNaNO2ת��Ϊ�����ʡ��÷�Ӧ���������У�
��һ��NaNO2+NH4Cl=NaCl+NH4NO2���ڶ���NH4NO2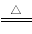 N2+2H2O�����жԵ�һ��������Ӧ����������ȷ���ǣ� ��
N2+2H2O�����жԵ�һ��������Ӧ����������ȷ���ǣ� ��
�ٵ�һ����Ӧ����������ԭ��Ӧ
�ڵڶ�����Ӧ��NH4NO2ֻ����ԭ��
�۵ڶ�����Ӧ���ǷֽⷴӦ������������ԭ��Ӧ
��������Ӧ�ж��ǵ�Ԫ�صĻ��Ϸ����˱仯
A���٢� B���ڢ� C���ۢ� D���٢�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�갲��ʡ��һ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ�У����ӷ���ʽ��д��ȷ���ǣ� ��
A��Fe�����ᷴӦ��2Fe+6H+�T2Fe3++3H2��
B���������������ᷴӦ��OH��+H+�TH2O
C��Cu��AgNO3��Һ��Ӧ��Cu+Ag+�TCu2++Ag
D��ʯ��ʯ�����ᷴӦ��CO32-+2H+�TCa2++CO2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶��϶����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�ں��¡������£��������·�Ӧ��2A��g��+2B��g�� C��g��+3D��g�����ִ�����;���ֱ���ƽ�⡣;����A��B����ʼŨ�Ⱦ�Ϊ2mol/L����;����C��D����ʼŨ�ȷֱ�Ϊ2mol/L��6mol/L������������ȷ���� �� ��
C��g��+3D��g�����ִ�����;���ֱ���ƽ�⡣;����A��B����ʼŨ�Ⱦ�Ϊ2mol/L����;����C��D����ʼŨ�ȷֱ�Ϊ2mol/L��6mol/L������������ȷ���� �� ��
A����ƽ��ʱ��;����ķ�Ӧ����V��A������;����ķ�Ӧ����V��A��
B����ƽ��ʱ��;�������û������Ũ�Ⱥ�;�������û�������Ũ�����
C����;�����մﵽƽ��ʱ����ϵ�ڻ������İٷ���ɲ�ͬ
D����;�����մﵽƽ��ʱ����ϵ�ڻ������İٷ������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�������и߶������в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£�pH���2������һԪ����ҺA��B���ֱ��ˮϡ��ʱ����Һ��pH�仯��ͼ��ʾ������˵����ȷ���ǣ� ��
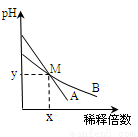
A��ȡ�����M���A��B���ּ�Һ����ͬŨ�ȵ�������Һ��ǡ����ȫ��Ӧʱ������������Һ�������ͬ
B���ô����к�A��Һ��ǡ����ȫ��Ӧʱ����Һ��pH��һ������7
C��ϡ��ǰ����Һ��H+Ũ�ȵĴ�С��ϵ��A=10B
D��ϡ��ǰ��A��Һ����ˮ�������OH-��Ũ�ȴ���10-7mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭�����и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���й����У��ƻ�����������ͬ����
A���ɱ������͵����� B��HCl����ˮ��NaCl����ˮ
C��ʯӢ�ۻ��ͱ��ۻ� D��NH4Cl���ȷֽ��HI���ȷֽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�찲��ʡ������ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��
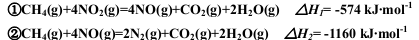
��CH4����ԭNOX�����˵����ȷ���ǣ� ��
A���ɢٿ���֪��CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O��1���ġ�H���ڡ�H1
B�������ʵ����ļ���ֱ����٢ڷ�Ӧ����ȫ��ת�Ƶĵ�������ͬ
C������0.2 mol CH4����������Ӧ��ԭ������NO2��N2���ų�������Ϊ173.4 kJ
D�����ñ�״����4.48 LCH4��ԭ������NO2��N2������������ת�Ƶĵ��ӵ����ʵ���Ϊ16 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�찲��ʡ�����ϵ��Ĵζο���ѧ�Ծ��������棩 ���ͣ�ʵ����
��ƽ�������ʾ�����������в����ķϲ�����ĩ�к��ж�������(CeO2).
��1���ڿ���������Ce(OH)CO3���Ʊ�CeO2,�÷�Ӧ�Ļ�ѧ����ʽ
��2����֪��һ��������,�������״̬��CeO2���Ʊ�Ce,д�������ĵ缫��Ӧʽ ��
��3��ij�������������ϲ�����ĩ(����SiO2��Fe2O3��CeO2�Լ���������������ϡ�������)Ϊԭ��,�����ͼ1���̶���Դ���л���,�õ�Ce(OH)4���������.

�ٵõ�����Bʱ,��Ҫ�����������ϴ�Ӹɾ�.ϴ�ӵIJ����� ��
�ڷ�Ӧ��1�������ӷ���ʽΪ ��
�۲���I��������
����ͼ2,������ԭ�ζ����ⶨ�Ƶõ�Ce(OH)4��Ʒ�Ĵ���.
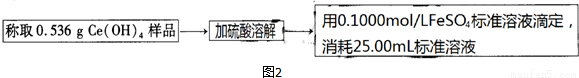
�ò�Ʒ��Ce(OH)4����������Ϊ (����С�������λ).���ζ�����FeSO4��Һ���ڿ�����¶����һ��ʱ��,���ø�Ce(OH)4��Ʒ�Ĵ��� (��ƫ�ߡ�����ƫ�͡�����Ӱ�족).
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016����������һ��ѧ�����ϵ������¿�����ѧ�Ծ��������棩 ���ͣ�ѡ����
��ѧ������������أ����й��������е�һЩ��������ѧ���� �� ��
A���ᳫʹ������
B��Al(OH)3������������
C����С�մ�����������ͷ
D���ý�Ũ������������Һϴ���·��ϵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������ʡ������ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ������
���Ų��Ͽ�ѧ�ķ�չ�����������仯����õ���Խ��Խ�㷺��Ӧ�ã�������Ϊ���Ͻ�ά���ء�����ҵ�ϻ��շϷ�����������V2O5��VOSO4��K2SO4��SiO2���з�����Ҫ�������£�
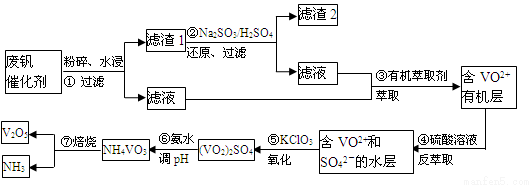
��֪����1��V2O5��NH4VO3��Ϊ�����VOSO4��(VO2)2SO4��Ϊ�����
��2�� VO2++H2C2O4+H+ �� VO2+ + CO2��+ H2O
�ش��������⣺
��1������ڵ�Ŀ���� ��
��2������۵ı仯���̿ɼ�Ϊ(HA��ʾ�л���ȡ��)��
VOSO4 (ˮ��)+ 2HA���л��㣩 VOA2(�л��㣩+ H2SO4(ˮ��)��������п�ѡ������������ȡ��ԭ���� ��
VOA2(�л��㣩+ H2SO4(ˮ��)��������п�ѡ������������ȡ��ԭ���� ��
��3����ClO3-������ԭΪCl-,��д������з�����Ӧ�����ӷ���ʽΪ ��
��4���������ữ��H2C2O4��Һ�ζ�(VO2)2SO4��Һ���Բⶨ�����ݺ���Һ�к������IJ���Ϊ��ȡ10.0mL0.1mol/LH2C2O4��Һ����ƿ�У�����ָ�����������Һʢ���ڵζ����У��ζ����յ�ʱ�����Ĵ���Һ�����Ϊ10.00mL���ɴ˿�֪(VO2)2SO4��Һ��Ԫ�صĺ���Ϊ g/L��
��5��V2O5���ý���(��Ca��Al)�Ȼ�ԭ����÷�����������Ȼ�ԭ�Ƶ÷��Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com