
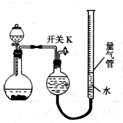
 某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu、稀HNO3 | NO | H2O |
| Ⅱ | NaOH(s)、浓氨水 | NH3 | |
| Ⅲ | 过氧化钠、水 | O2 | H2O |
| Ⅳ | 镁铝合金、NaOH溶液 | H2 | H2O |

| 编号 | 镁铝合金 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
分析 (1)实验Ⅰ装置中有空气,一氧化氮与空气反应生成二氧化氮,二氧化氮溶于水;
(2)实验Ⅲ用电石和水反应制取乙炔,乙炔可以燃烧,燃烧时火焰明亮并伴有浓烈的黑烟;
(3)氨气极易溶于水,量气管中的液体应该不含水且不与氨气反应,最好用煤油;
(4)极易溶于水的气体,若吸收时导管伸入水中,由于气体溶于水,导致装置内压强急剧降低,外界大气压压着液体进入,产生倒吸现象;
(5)对量气管读数时,首先等实验装置恢复到室温再进行下一步操作,然后调节量气管使左右液面相平,最后读数时视线与凹液面最低处相平.;
(6)实验Ⅳ,铝和氢氧化钠反应,根据量气管的第二次读数-第一次读数=生成氢气的体积,求出生成氢气的平均值,再求出合金中铝的质量,最后计算出镁铝合金中铝的质量分数.
解答 解:(1)一氧化氮与氧气反应生成二氧化氮,二氧化氮可与水反应生成一氧化氮和硝酸;装置Ⅰ中有空气,一氧化氮会与装置中的空气反应,生成的二氧化氮溶于水并与水反应,使测得的一氧化氮体积不准,所以不可以通过实验I收集并测量NO气体的体积来探究铜样品的纯度,
故答案为:不可行;NO会与装置中空气反应,生成NO2溶于水,使测得的NO气体体积不准;
(2)实验室用电石和水来制取乙炔,反应原理为:CaC2+2H2O→Ca(OH)2+C2H2↑,乙炔可以燃烧,乙炔燃烧时,火焰明亮并伴有浓烈的黑烟,这是因为乙炔中含碳的质量分数比乙烯高,碳没有完全燃烧的缘故,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑,火焰明亮并伴有浓烈的黑烟;
(3)氨气为碱性气体,极易溶于水,量气管中的液体应该不含水且不与氨气反应,浓NaOH溶液、氨水、氯化铵溶液中含有水,氨气被水吸收,而氨气不溶于煤油,所以量气管中液体最好是煤油,
故答案为:c;
(4)A、对于极易溶于水的气体,吸收装置中的导管外联双球状导管内伸入到液体中,液体进入双球内,防止进入前端装置,能防止倒吸;故A正确;
B、吸收装置中的导管下联漏斗,漏斗口伸入液面以下,易吸收易溶性气体,不能防止倒吸;故B不正确;
C、对于极易溶于水的气体,吸收装置中的导管与干燥管连接,当水进入干燥管内,烧杯内液面下降低于导管口,液体又流落到烧杯中,能防止倒吸,故C正确.
D、氨气极易溶于水,不溶于四氯化碳,所以导管通入四氯化碳中,气泡向上到水层溶解,能防止倒吸,故D正确;
E、氨气极易溶于水,导管插入溶液中形成喷泉,进气管在烧瓶口,液体经进气管倒流入前端装置,产生倒吸,故E错误;
F、氨气极易溶于水,导管插入溶液中形成喷泉,进气管在烧瓶底部,液体不能流入前端装置,能防止倒吸,故F正确;
所以能防倒吸的吸收装置有ACDF,
故答案为:ACDF;
(5)根据PV=nRT,为保证测出来的气体体积是当时大气压下的体积,在读数时应注意:①将实验装置恢复到室温,②使量气管两端液面相平,因为相平说明两边液面上的压强是一样的,这样测出来的气体体积才是当时大气压下的体积,③视线与凹液面最低处相平,俯视或仰视会造成误差,
故答案为:使量气管与干燥管两端液面相平;
(6)第2次测量数据误差较大,可不用,铝和氢氧化钠反应生成氢气的体积=$\frac{(346.3-10)+(345.7-10)}{2}$=336.0mL=0.336L
设生成0.336L氢气,需铝的质量为x
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
54g 3×22.4L
x 0.336L
解之得:x=0.27g
铝的质量分数=$\frac{0.27g}{1.0g}$×100%=27.0%.
故答案为:27.0%.
点评 本题考查了气体制备、气体性质、气体制备装置选择、误差分析等,测定气体体积的方法,了解了点燃可燃性气体前要检验纯度,极易溶于水的气体的防倒吸,注意排液量气法的注意问题,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
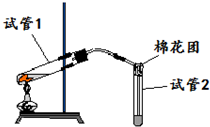 如图是实验室用铜片与浓硫酸反应制取SO2,并验证其性质的装置图.往试管1中加入一小块铜片,再加入3~5mL浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管2的溶液中.回答以下问题:
如图是实验室用铜片与浓硫酸反应制取SO2,并验证其性质的装置图.往试管1中加入一小块铜片,再加入3~5mL浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管2的溶液中.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向MgCl2溶液中加入过量的NaOH溶液,Mg2+沉淀完全,则溶液中不含Mg2+ | |
| B. | Ksp小的物质其溶解能力一定比Ksp大的物质的溶解能力小 | |
| C. | 25℃时,由于Kw(ZnS)>Kw(CuS),所以ZnS在一定条件下可转化为CuS | |
| D. | 0.1molAgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:4 | B. | 1:2 | C. | 1:4 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,浓度均为0.10mol/L,体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
室温下,浓度均为0.10mol/L,体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )| A. | 稀释前两溶液的Ka:MOH溶液>ROH溶液 | |
| B. | ROH的电离程度:b点小于a点 | |
| C. | 两溶液在稀释过程中,c(H+)均逐渐减少 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,则$\frac{c({R}^{+})}{c({M}^{+})}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物一定是金属氧化物,金属氧化物一定是碱性氧化物 | |
| B. | 由同种元素组成的物质是单质,由多种元素组成的物质是混合物 | |
| C. | 酸性氧化物一定是非金属氧化物,非金属氧化物一定是酸性氧化物 | |
| D. | 溶液、胶体、浊液一定都是混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com