
【题目】下列关于实验操作的说法正确的是
A.稀释浓硫酸时,将蒸馏水沿器壁缓慢注入浓硫酸中
B.过滤时,漏斗里液体的液面要高于滤纸边缘
C.蒸发过程中,蒸发皿中没有水时才能停止加热
D.点燃可燃性气体如H2、CO等时,先检验气体纯度后点燃
 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO47H2O的工艺流程如下:(己知Cd的金属活动性介于Zn和Fe之间)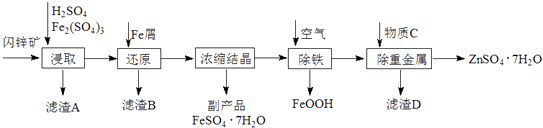
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 .
(2)浸取过程中Fe2(SO4)3的作用是 , 浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 .
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 . 该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 .
(4)置换法除重金属离子是Cd2+ , 所用物质C为 .
(5)硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为、、过滤、干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“固体干冰→液体二氧化碳→气体二氧化碳→气体一氧化碳”的变化过程中,被破坏的作用力依次是
A.范德华力、范德华力、范德华力
B.范德华力、范德华力、共价键
C.范德华力、共价键、共价键
D.共价键、共价键、共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】贝诺酯主要用于类风湿性关节炎、风湿痛等.其合成路线如图所示: 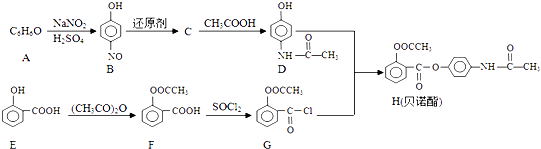
回答下列问题:
(1)A的结构简式为;E中含氧官能团的名称为 .
(2)D+G→H的反应类型为;C的结构简式为 .
(3)写出F与足量NaOH溶液反应的化学方程式: .
(4)写出符合下列条件的E的同分异构体结构简式 .
a.分子中含有苯环 b.能发生水解反应 c.核磁共振氢谱有4组峰
(5)请根据题中合成路线图有关信息,写出以甲苯和苯酚为原料制备 ![]() 的合成路线流程图(无机试剂可任选): .
的合成路线流程图(无机试剂可任选): .
合成路线流程图示例如下:CH3CHO ![]() CH3COOH
CH3COOH ![]() CH3COOCH2CH3 .
CH3COOCH2CH3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用含有少量氯化钙的氯化钠固体,配制100 mL 1mol·L-1的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:
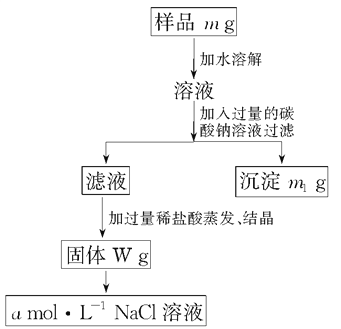
(1)称量粗盐样品m g,所用仪器名称为:_____________。
(2)过滤时,玻璃棒的作用是:__________________。
(3)蒸发操作时应将液体放在__________中加热,等加热至________时即停止加热。
(4)在样品的溶液中加入过量的Na2CO3溶液,作用是__________________,反应的化学方程式是______________________________________。
(5)在滤液中加入盐酸的作用是____________________________________,
反应的离子程式是_______________________________________。
(6)配制100 mL 1 mol·L-1的NaCl溶液时,应从W g固体中称取NaCl的质量为________,配制时应在________中进行定容。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题: 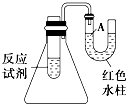
(1)将铝片加入小试管内,然后注入足量稀盐酸,有关反应的离子方程式是 , 试管中观察到的现象是 .
(2)U形导管中液面A(填“上升”或“下降”),原因是 , 说明此反应是(填“吸热”或“放热”)反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也令人体会到化学方法在文物保护中的巨大作用。某博物馆修复出土铁器的过程如下。
(1)检测锈蚀产物
主要成分的化学式 | |||
Fe3O4 | Fe2O3·H2O | FeO(OH) | FeOCl |
铁器在具有O2、________等环境中容易被腐蚀。
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
Ⅰ. Fe转化为Fe2+ 。
Ⅱ. Fe2+在自然环境中形成FeO(OH),该物质中铁元素的化合价为_______。
Ⅲ. FeO(OH)和Fe2+反应形成致密的Fe3O4保护层,Fe2+的作用是_______。
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
Ⅳ. Fe3O4保护层被氧化为FeO(OH),如此往复腐蚀。
![]() (将反应补充完整)___________
(将反应补充完整)___________
(3)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成Fe3O4保护层,方法如下:
将铁器浸没在盛有0.5 mol/L Na2SO3、0.5 mol/L NaOH溶液的容器中,缓慢加热至60~90℃。一段时间,取出器物,用NaOH溶液洗涤至无Cl-。
① 检测洗涤液中Cl-的方法是________。
② 脱氯反应:FeOCl + OH-=FeO(OH) + Cl-。离子反应的本质是离子浓度的减小,比较FeOCl 与FeO(OH)溶解度的大小:________。
③ Na2SO3还原FeO(OH)形成Fe3O4的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在以下各种情形下,下列电离方程式的书写正确的是( )
A.熔融状态下的NaHSO4电离:NaHSO4═Na++H++SO ![]()
B.Fe(OH)3的电离:Fe(OH)3?Fe3++3OH﹣
C.H2CO3的电离:H2CO3?2H++CO ![]()
D.水溶液中的NaHSO4电离:NaHSO4═Na++HSO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液、胶体和浊液这三种分散系的根本区别是( )
A.是否是大量分子或离子的集合体
B.是否能通过滤纸
C.分散质粒子直径的大小
D.是否均一、透明、稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com