
(16分)(1)乙醇是重要的有机化工原料,可由乙烯直接水合法生产。
已知:甲醇脱水反应①2CH3OH(g) = CH3OCH3(g)+H2O(g)?△H1=-23.9KJ·mol-1
甲醇制烯烃反应②2CH3OH(g) = C2H4 (g)+2H2O(g)?△H2=-29.1KJ·mol-1
乙醇异构化反应③CH3CH2OH(g) = CH3OCH3(g))? △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g) C2H5OH(g) △H= ;
C2H5OH(g) △H= ;
(2)乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图。结合曲线归纳平衡转化率-T曲线变化规律:
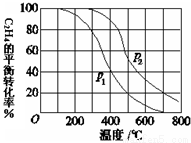
(a) ;
(b) ;
(3)若要进一步提高乙烯的转化率,可以采取的措施有 。
A.增大乙烯的浓度 B.分离出乙醇 C.加催化剂
(4)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时FeO(s)转化率为50%,求x的值。(写出计算步骤)
(16分(1)-45.5 kJ·mol-1(2分,错写或漏写单位扣1分,数值错,0分)
(2)(a)其他条件相同,温度升高,C2H4的平衡转化率降低;(2分,合理给分)
(b)其他条件相同,增大压强, C2H4的平衡转化率增大。(2分,合理给分)
(3)B (2分) (4)①4:1 (2分) ②0.05
【解析】
试题分析:(1)已知:甲醇脱水反应 ①2CH3OH(g)═CH3OCH3(g)+H2O(g)△H1=-23.9kJ?mol-1、甲醇制烯烃反应 ②2CH3OH(g)═C2H4(g)+2H2O(g)△H2=-29.1kJ?mol-1、乙醇异构化反应 ③C2H5OH(g)═CH3OCH3(g)△H3=+50.7kJ?mol-1,根据盖斯定律①-②-③可得:C2H4(g)+H2O(g)═C2H5OH(g)△H=(-23.9+29.1-50.7)kJ/mol=-45.5kJ/mol;
(2)根据图像的变化曲线可知:(a)其他条件相同,温度升高,C2H4的平衡转化率降低;(b)其他条件相同,增大压强, C2H4的平衡转化率增大。
(3)A.增大乙烯的浓度,平衡向正反应方向碱性,但乙烯的转化率降低,A错误;B.分离出乙醇,降低生成物浓度,平衡向正反应方向碱性,乙烯转化率增大,B正确;C.加催化剂不能改变平衡状态,转化率不变,C错误,答案选B。
(4)①已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25,则反应达到平衡时n(CO):n(CO2)=1/K=1/0.25=4:1;
Fe(s)+CO2(g)的平衡常数K=0.25,则反应达到平衡时n(CO):n(CO2)=1/K=1/0.25=4:1;
②FeO(s) + CO(g)  Fe(s) + CO2(g)
Fe(s) + CO2(g)
起始时物质的量(mol) 0.02 x 0 0
变化的物质的量(mol) 0.02×50% 0.01 0.01 0.01
平衡时物质的量(mol) 0.01 x-0.01 0.01 0.01
根据平衡常数K=0.25得:
解得x=0.05
考点:考查盖斯定律的应用、外界条件对平衡状态的影响以及平衡常数的应用与计算


科目:高中化学 来源:2014秋季甘肃省高二第一学期期中考试文科化学试卷(解析版) 题型:选择题
正常情况下,人体血液的pH的范围是
A.8.67~9.26 B.7.35~7.45 C.7.00 D.大于5.70
查看答案和解析>>
科目:高中化学 来源:2014秋季湖南省高二上学期第一次阶段测试化学(B)试卷(解析版) 题型:选择题
.在溶液中发生的反应,对反应速率不发生影响的因素是
A.温度 B.压强 C.浓度 D.催化剂
查看答案和解析>>
科目:高中化学 来源:2015届广东省肇庆市高三一模理综化学试卷(解析版) 题型:填空题
(16分)(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
① CH4(g)+H2O(g)=CO(g) + 3H2(g) △H =+206.0 kJ·mol-1
② CO(g)+2H2(g)=CH3OH (g) △H =-129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的△H= 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应器,在一定条件下发生反应①,测得在一定压强下CH4的转化率与温度的关系如图。

假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 mol·L-1·min-1。
(3)在某温度和压强下,将一定量 CO与H2充入密闭容器发生反应②生成甲醇,平衡后压缩容器体积至原来的l/2,其他条件不变,对平衡体系产生的影响是 (填序号):
A.c ( H2 )减少;
B.平衡常数K增大;
C.CH3OH 的物质的量增加;
D.正反应速率加快,逆反应速率减慢;
E.重新平衡c ( H2 )/ c (CH3OH )减小。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用图装置模拟上述过程,

则: Co2+在阳极的电极反应式为: ;除去甲醇的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省肇庆市高三一模理综化学试卷(解析版) 题型:选择题
下列各组离子能在水溶液中大量共存的是
A.H+、Fe2+、ClO-、SO42- B.Na+、Cu2+、S2-、ClO-
C.Na+、Ba2+、OH-、NO3- D.Na+、Al3+、SiO32-、CO32-
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市毕业班调研测试理综化学试卷(解析版) 题型:选择题
常温下,0.1 mol·L-1的一元酸HA与0.1 mol·L-1的NaOH溶液等体积混合后,所得溶液pH>7, 下列说法正确的是
A.混合前一元酸HA的c(H+)=0.1 mol·L-1
B.该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
C.HA在水溶液中的电离方程式:HA = H+ + A-
D.该混合溶液中:c(A-)+ c(HA)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:填空题
(16分)在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+ O2 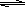 2SO3
2SO3
(1)已知:64g SO2完全转化为SO3会放出85kJ热量。 SO2转化为SO3的热化学方程式是 。
(2)该反应的化学平衡常数表达式K= 。
(3)降低温度,化学反应速率 。该反应K值将 。(填“增大”或“减小”或“不变”)
(4)450℃时,在一密闭容器中,将二氧化硫与氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间段是 。
a.10-15min b.15-20min c.20-25min d.25-30min
(5)据图判断,10min到15min的曲线变化的原因可能是 (填写编号)。
a.增加SO3的物质的量 b.增大容器体积 c.降低温度 d.催化剂
(6)在15分钟时,SO2的转化率是 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高一第一学期期中考试化学试卷(解析版) 题型:选择题
用10 mL的0.1 mol·L-1 BaCl2溶液恰好可使相同体积的Fe2(SO4)3、ZnSO4和K2SO4三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是
A.1∶2∶3 B.3∶2∶2 C.3∶1∶1 D. 1∶3∶3
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:填空题
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为 。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)写出与BD2互为等电子体的C3-的结构式 。
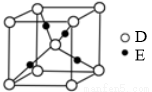
(4)E+的核外电子排布式为 ,下图是D、E形成的某种化合物的晶胞结构示意图,该晶体1个晶胞中阳离子的个数为 。
(5)向E的硫酸盐溶液中通入过量的CA3,可生成[E(CA3)4]2+配离子,1 mol [E(CA3)4]2+中含有σ键的数目为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com