
| 选项 | 目 的 | 实验方法 |
| A | 除去Na2CO3固体中的NaHCO3 | 置于坩埚中加热至恒重 |
| B | 除去NaCl中少量KNO3 | 将混合物制成热饱和溶液,冷却结晶,过滤 |
| C | 除去CO2中的HCl气体 | 通过NaHCO3(aq,饱和),然后干燥 |
| D | 除去C2H5Br中的Br2 | 加入足量Na2SO3(aq),充分振荡,分液 |
 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源:不详 题型:单选题
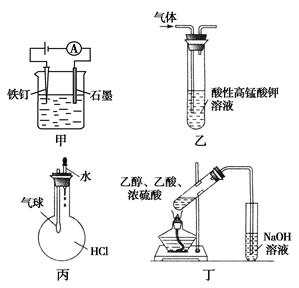
| A.装置甲:为防止铁钉生锈 |
| B.装置乙:除去一氧化碳中混有的乙烯 |
| C.装置丙:验证HCl气体在水中的溶解性 |
| D.装置丁:实验室制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用氨水鉴别Al3+、Mg2+和Ag+ |
| B.用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- |
| C.菠菜中铁元素含量较高,为证明菠菜中的铁元素是+2价还是+3价,可把菠菜捣碎加水溶解,再向过滤后的滤液中加硫氰化钾溶液 |
| D.加入稀盐酸产生使澄清石灰水变浑浊的气体,则原溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.①④ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
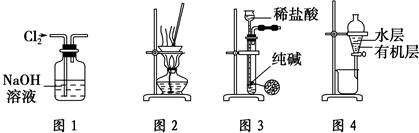
| A.用图1所示装置除去Cl2中含有的少量HCl |
| B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| C.用图3所示装置制取少量纯净的CO2气体 |
| D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
| B.用水湿润pH试纸测量某溶液的pH,一定会产生实验误差 |
| C.容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,必须用所盛溶液润洗几次后方可使用 |
| D.称取a克Na2CO3和NaHCO3混合物充分加热,减重b克,可测定混合物中Na2CO3的质量分数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Br- | B.SO42- | C.H2SO3 | D.NH4+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 某钠盐溶液中加入盐酸酸化的硝酸钡溶液有白色沉淀 | 说明该钠盐是硫酸钠或硫酸氢钠 |
| B | 向混有乙酸和乙醇的乙酸乙酯的混合物中,加入饱和Na2CO3溶液洗涤、分液 | 得到较纯净的乙酸乙酯 |
| C | 向裂化汽油中加入酸性高锰酸钾溶液,振荡,紫色褪去 | 说明汽油中含有甲苯等苯的同系物 |
| D | 向含有少量的FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | ①气体成分为________ |
| 实验Ⅲ | ②取实验Ⅰ中的白色不溶物,洗涤,加入足量________ | ③________________ __________________ __________________ | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | ④溶液中存在________ |
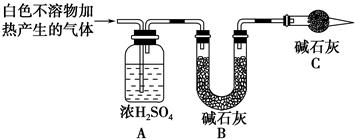
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com