
| A. | 用酒精萃取碘水中的碘 | |
| B. | 蒸馏操作时,温度计的水银球要插入溶液中 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用分液漏斗分离水和四氯化碳时,水从上口倒出,四氯化碳从下口放出 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
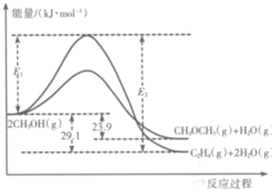
起始投料/mol 编号 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 恒温容器1 | 2 | 0 | 0 |
| 恒温容器2 | 0 | 2 | 2 |
| 绝热容器3 | 2 | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C1>C2 | B. | 2C1=C2 | C. | 2C1<C2 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y>Z>X | |
| B. | 气态氢化物的稳定性:Z<X | |
| C. | Y、Z的氧化物都有两性 | |
| D. | Y、W最高价氧化物对应水化物间可以相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质焰色反应呈黄色,结论:该物质一定是钠盐 | |
| B. | 无色盐溶液中加入NaOH溶液,加热后产生的气体能使湿润的红色石蕊试纸变蓝,结论:原溶液中一定含有NH4+ | |
| C. | 无色溶液中加入BaCl2溶液,有白色沉淀产生,再加稀硝酸,沉淀不消失,结论:原溶液一定含有SO42- | |
| D. | 无色溶液中加入稀盐酸,产生无色无味气体,该气体能使澄清石灰水变浑浊,结论:原溶液一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
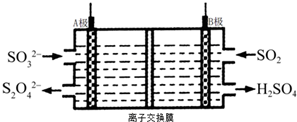
| A. | A电极接电源的正极 | |
| B. | A极区溶液的碱性逐渐增强 | |
| C. | 本装置中使用的是阴离子交换膜 | |
| D. | B极的电极反应式为SO2+2e-+2H2O═SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
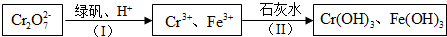
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com