
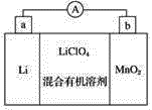
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质是LiClO4,溶于混合有机溶剂中,金属锂离子(Li+)通过电解质迁移入二氧化锰晶格中,生成LiMnO2。
回答下列问题:
(1)外电路的电流方向是由________极流向________极(填字母)。
(2)电池的正极反应式为___________。
(3)是否可用水代替电池中的混合有机溶剂________(填“是”或“否”),原因是_______。
【答案】b a MnO2+e-+Li+=LiMnO2 否 电极锂是活泼金属,能与水反应
【解析】
根据原电池原理及图示电池构造判断电池正负极,书写电极反应;根据电极的性质及电解质溶液的性质分析解答。
在锂锰电池中,金属锂为负极(a极),电极反应式为Li-e-![]() Li+;二氧化锰为正极(b极),电极反应式为MnO2+e-+Li+
Li+;二氧化锰为正极(b极),电极反应式为MnO2+e-+Li+![]() LiMnO2;在其外电路中,电子由负极(a极)流向正极(b极),而电流方向则由正极(b极)流向负极(a极);负极材料锂是活泼的金属,能与水发生反应,不能用水代替电池中的混合有机溶剂。故答案为:b ;a;MnO2+e-+Li+=LiMnO2;电极锂是活泼金属,能与水反应。
LiMnO2;在其外电路中,电子由负极(a极)流向正极(b极),而电流方向则由正极(b极)流向负极(a极);负极材料锂是活泼的金属,能与水发生反应,不能用水代替电池中的混合有机溶剂。故答案为:b ;a;MnO2+e-+Li+=LiMnO2;电极锂是活泼金属,能与水反应。


科目:高中化学 来源: 题型:
【题目】下列解释对应事实的离子方程式正确的是
A.FeSO4溶液中滴加NaOH溶液,静置一段时间后:Fe2++2OH一=Fe(OH)2↓
B.漂白粉溶液加入醋酸:H++ClO-=HC1O
C.AgCl悬浊液滴入Na2S溶液:2Ag++S2-=Ag2S↓
D.K2 CrO4溶液滴入硫酸溶液;2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新华社报道:全国农村应当在“绿色生态·美丽多彩·低碳节能·循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃、101kPa时:
①C(s)+![]() O2(g)=CO(g) ΔH=-126.4kJ/mol
O2(g)=CO(g) ΔH=-126.4kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
③H2O(g)=H2O(l) ΔH=-44kJ/mol
则在25℃、101kPa时:
C(s)+H2O(g)=CO(g)+H2(g) ΔH=_____。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH>0
Fe(s)+CO2(g) ΔH>0
已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值____(填“增大”“减小”或“不变”)。
②1100℃时测得高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L,则在这种情况下,该反应是否处于化学平衡状态?____(填“是”或“否”),其判断依据是___。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。
现向体积为1L的恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=____。
②下列措施能使![]() 增大的是____(填字母)。
增大的是____(填字母)。
A.升高温度
B.再充入H2
C.再充入CO2
D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中应用广泛。
(1)已知: ①3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H1=a kJ·mol-1;
②2H2(g)+O2(g)=2H2O(1) △H2=b kJ·mol-1
③H2O(g)=H2O(l) △H3=c kJ·mol-1
则3Fe(s)+2O2(g))=Fe3O4(s)△H=_________kJ·mol-1(用含 a、b、c 的代数式表示)。
(2)活性铁粉是合成氨气的催化剂。工业合成氨的原理为N2+3H2![]() 2NH3 △H<0
2NH3 △H<0
①工业采用“高压”一般为20~50MPa,温度为 500℃。采用“温度为 500℃”的目的是____________;
②氨气是合成氮肥的重要原料。常温下,0.1mol·L-1(NH4)2SO4溶液中离子浓度大小排序为___________;
③常温下,向a mL c mol·L-1氨水中滴加b mL c mol·L-1稀硝酸恰好至溶液pH=7(溶液体积变化忽略不计),则NH3·H2O的电离常数Kb=___;
(3)工业上用热还原法冶炼铁。在密闭容器中,投人足量的 FeO 粉末和炭粉,在一定温度下发生反应:FeO(s)+C(s)Fe(s)+CO(g) △H>0;
①若容积恒定,则下列情况表明上述反应达到平衡状态的是___________(填代号)
A.FeO 的浓度不再改变 B.气体相对分子质量不再改变 C.气体密度不再改变 D.铁粉的质量不再改变
②在该温度下,上述反应达到平衡时c(CO)=a mol·L-1,则该反应的平衡常数为________;在温度不变时,将容器体积扩大至原来的4倍,则达到新平衡时,c(CO)为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中粒子浓度的说法不正确的是
A.0.1mol·L-1NaHCO3溶液:c(Na+)>c(CO32-)>c(H2CO3)>c(OH-)>c(H+)
B.Na2S稀溶液:c(H+)=c(OH-)-2c(H2S)-c(HS-)
C.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化,反应的离子方程式:2MnO4-+5C2O42-+6H+=2Mn2++10CO2↑+8H2O,MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O。
某研究小组为测定某软锰矿中MnO2的质量分数,实验步骤如下:
准确称取1.00g软锰矿样品,加入2.68g Na2C2O4,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液全部转移到250mL容量瓶中并定容。取出25.00mL待测液置于锥形瓶中,再用0.0200mol·L-1 KMnO4标准溶液进行滴定,当滴入20.00mL KMnO4溶液时恰好完全反应。
(1)0.0200mol·L-1 KMnO4标准溶液应置于______滴定管中(填“酸式”或“碱式”),判断滴定终点的依据是_______。
(2)根据实验数据计算,软锰矿中MnO2的质量分数为________。
(3)判断下列情况对测定结果的影响(填“偏大”、“偏小”或“无影响”)。若溶液转移至容量瓶中,未洗涤烧杯和玻璃棒,会使测定结果________;若未用KMnO4标准溶液润洗滴定管,会使测定结果________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸铝、硫酸钾和明矾的混合溶液中,硫酸根离子的浓度为0.4mol·L-1,当加入等体积0.4mol·L-1氢氧化钾溶液时,生成的沉淀恰好完全溶解。则反应后溶液中钾离子的浓度约为( )
A.0.225mol·L-1B.0.25mol·L-1C.0.45mol·L-1D.0.9mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(1)CO2用于生产乙烯,已知:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=QkJ/mol。一定条件下,按不同的投料比X[X=
CH2=CH2(g)+4H2O(g) △H=QkJ/mol。一定条件下,按不同的投料比X[X=![]() ]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
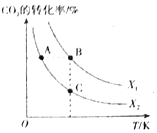
①X1___X2(填“>”或“<”,后同),Q___0。
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为___。
(2)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(CO![]() ):c(HCO
):c(HCO![]() )=___[常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
)=___[常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
②欲用5LNa2CO3溶液将23.3gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为___。[已知:常温下Ksp(BaSO4)=1×10-7、Ksp(BaCO3)=2.5×10-6].(忽略溶液体积积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是___;
(2)烧杯间填满碎纸条的作用是___;
(3)用相同浓度和体积的氨水(NH3· H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会___(填“偏大”、“偏小”或“无影响”)。
(4)实验中改用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等”、“不相等”),所求中和热___,(填“相等”、“不相等”)。
Ⅱ.(1)已知充分燃烧一定质量的丁烷(C4H10)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示丁烷燃烧热的热化学方程式为___;
(2)0.3mol的气态高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态B2O3和液态水,放出649.5kJ的热量,其热化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com