
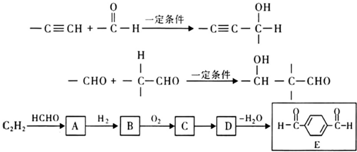
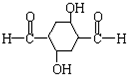
 ,D在浓硫酸、加热条件下发生消去反应生成E,据此解答.
,D在浓硫酸、加热条件下发生消去反应生成E,据此解答. ,D在浓硫酸、加热条件下发生消去反应生成E,
,D在浓硫酸、加热条件下发生消去反应生成E, ,属于加成反应,
,属于加成反应, ,加成反应;
,加成反应; ,
, ;
; ,
, 任意一种;
任意一种; 在浓硫酸、加热条件下发生消去反应生成E,故答案为:浓硫酸、加热.
在浓硫酸、加热条件下发生消去反应生成E,故答案为:浓硫酸、加热.


科目:高中化学 来源: 题型:
| c(B) |
| c(C) |
| A、③④ | B、①②⑤ |
| C、②③⑤ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol?L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol?L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ④ |
| ⑤KMnO4/H+ |
| ⑥ |
| ⑦酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
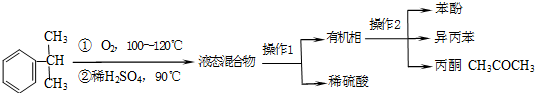
| 物质 | 沸点 | 溶解性 | 主要化学性质 |
| 异丙苯 | 152.4℃ | 不溶于水,易溶于酒精. | 可被强氧化剂氧化 |
| 苯酚 | 181.8℃ | 微溶于冷水,易溶于热水和酒精等有机溶剂. | 易被氧化 |
| 丙酮 | 56.2℃ | 易溶于水和有机溶剂 | 不易被氧化 |
| 检验项目 | 实验方案 |
| 检验丙酮中一定存在有机杂质的方法是 | A.酸性KMnO4溶液,加热 B.乙醇,溶解 C.NaOH溶液(酚酞),加热 |
| 检验丙酮中一定含有苯酚的方案是: | 取少许待测液置于试管中,滴加1~2滴FeCl3溶液.预期的实验现象和结论是 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 NO3-+
NO3-+ ═
═ Fe2++
Fe2++ NH4++
NH4++
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成.
某同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等质量的铝分别与足量氢氧化钠溶液和稀硝酸反应,放出的氢气一样多 |
| B、将SO2通入过量Ba(NO3)2溶液可生成BaSO4沉淀 |
| C、自来水厂常用明矾对水进行杀菌、消毒 |
| D、将稀硫酸滴加到Fe(NO3)2溶液中无明显现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com