
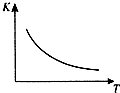
 工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2 (g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定容积的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如表:已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2 (g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定容积的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如表:已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:| 时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
分析 (1)由图可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,据此判断△H;
(2)平衡常数只与温度有关;
(3)根据三段式解题法,求出反应混合物各组分浓度的变化量、平衡时各组分的浓度,转化率=$\frac{CO的浓度变化}{CO的起始浓度}$×100%.
解答 解:(1)由图可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故△H<0,故答案为:<;
(2)在850℃时向反应容器中充入H2O(g),平衡正向移动,但K值不变;故答案为:不变;
(3)CO+H2O(g)?CO2 +H2,
起始(mol/L) 0.200 0.300 0 0
反应(mol/L) a a a a
平衡(mol/L) 0.200-a 0.300-a a a
K=$\frac{a×a}{(0.200-a)•(0.300-a)}$=1,解得a=0.12,
所以c2=0.300-a=0.18,CO(g)的转化率为$\frac{CO的浓度变化}{CO的起始浓度}$×100%=$\frac{0.12}{0.200}$×100%=60%,
故答案为:0.18;60%.
点评 本题考查化学平衡常数及影响因素、平衡移动以及计算等,难度中等,注意化学平衡常数是温度的函数,温度不变K不变.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要完成实验需称取10.6gNa2CO3•10H2O晶体 | |
| B. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度线,会导致溶液浓度偏高 | |
| C. | 配制时若容量瓶不干燥,含有少量蒸馏水会导致浓度偏低 | |
| D. | 定容时俯视刻度线会导致浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | Na2SO4溶液中:c(Na+)+c(H+)=2c(SO42-)+c(OH-) | |
| C. | NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H+)>c(OH-) | |
| D. | 浓度均为0.1 mol/L的CH3COOH与CH3COONa溶液等体积混合所得溶液中:c (CH3COOH)+c(CH3COO-)=0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A. | ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大 | |
| B. | V1L④与V2L①混合,若混合后溶液pH=7,则V1<V2 | |
| C. | 分别加水稀释10倍后,四种溶液的pH①>②>④>③ | |
| D. | ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
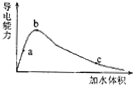
| A. | 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) | |
| B. | 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小 | |
| C. | 混合溶液中含有等物质的量的Na2CO3和NaHCO3,则一定存在c(Na+)+c(H+)═c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大于a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英与烧碱溶液共热:SiO2+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$SiO32-+H2O | |
| B. | 在氯化铝溶液中滴加过量的氨水:Al3++4OH-=[Al(OH)4]- | |
| C. | 在氢氧化钠溶液中通入过量的CO2:2OH-+CO2=CO32-+H2O | |
| D. | 稀硫酸与氢氧化钡溶液反应H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com