
| A. | 该反应中的还原剂为KNO3 | |
| B. | 该反应中C被还原 | |
| C. | 若消耗32gS,转移电子数为10mol | |
| D. | 若生成标准状况下气体22.4L,则有0.75 mol物质被还原 |
分析 反应S+2KNO3+3C═K2S+N2↑+3CO2↑中,N和S元素化合价降低,被还原,C元素化合价升高,被氧化,据此分析.
解答 解:A.反应中N和S元素化合价降低,被还原,C元素化合价升高,所以还原剂是C、氧化剂是S和KNO3,故A错误;
B.C元素化合价升高,所以还原剂是C被氧化,故B错误;
C.消耗32gS即1mol,则消耗3molC,所以转移电子数为(4-0)×3mol=12mol,故C错误;
D.生成标准状况下22.4L气体时,即1mol气体,则生成$\frac{1}{4}$×1mol=0.25mol氮气,有0.25molS和0.5molKNO3参加反应,又反应中N和S元素化合价降低,被还原,则有0.75 mol物质被还原,故D正确.
故选D.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,题目难度不大,本题注意把握元素化合价的变化,从化合价的角度理解氧化还原反应.


科目:高中化学 来源: 题型:选择题
| A. | 用天平(用了游码)称量时,被称量物与砝码的位置放颠倒了 | |
| B. | 溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 | |
| C. | 转移溶液前容量瓶内有少量蒸馏水 | |
| D. | 定容时,俯视容量瓶的刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增加 | |
| B. | 对于有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 改变条件能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的有效碰撞几率 | |
| D. | 对于本来不能发生的化学反应,改变条件可以使反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 混合物成分 | 除杂试剂 | 化学方程式 |
| (1)铜粉中混有铁粉 | ||
| (2)铁粉中混有铝粉 | ||
| (3)Al2O3中混有Al(OH)3 | ||
| (4)FeCl3溶液中混有FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.12g | B. | 4.18g | C. | 4.68g | D. | 5.08g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
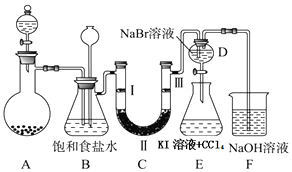
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 无水氯化钙 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com