
| 序号 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 |  选用滴定管 选用滴定管 |
| A | 碱 | 酸 | 石芯 | (乙) |
| B | 酸 | 碱 | 酚酞 | (甲) |
| C | 碱 | 酸 | 甲基橙 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
| 实验 编号 | 待测氢氧化钠溶液体积(mL) | 滴定开始读数(mL) | 滴定结束读数(mL) | 消耗盐酸体积(mL) |
| ① | 25.00 | 0.02 | 26.40 | |
| ② | 25.00 | 0.04 | 25.81 | |
| ③ | 25.00 | 0.03 | 25.78 | |
| ④ | 25.00 | 0.20 | 25.96 |
| cV碱 |
| V酸 |
| cV碱 |
| V酸 |
| cV碱 |
| V酸 |
| cV碱 |
| V酸 |
| cV碱 |
| V酸 |
| 0.02576L×0.112mol/L |
| 0.025L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油的裂化属于物理变化 |
| B、氯乙烯和乙二醇均可作为合成聚合物的单体 |
| C、淀粉、蛋白质、脂肪和葡萄糖都可发生水解反应 |
| D、在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
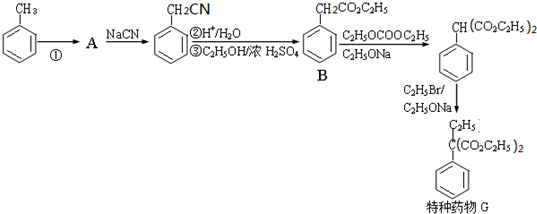
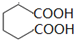 ,请设计合成路线(无机试剂及溶剂任选).
,请设计合成路线(无机试剂及溶剂任选).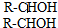
| pb(OAc)4 |
| H2/催化剂 |
| 加热加压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
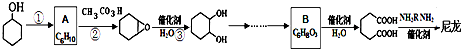
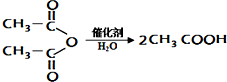
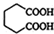 合成尼龙的化学方程式为
合成尼龙的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
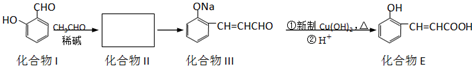
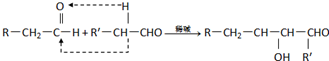
查看答案和解析>>
科目:高中化学 来源: 题型:
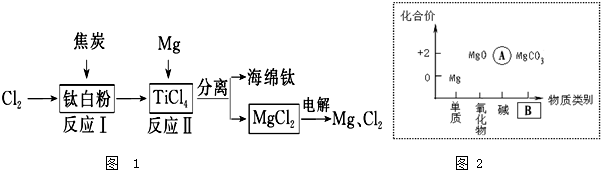
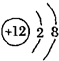 为镁元素的某种粒子结构示意图,该图表示(填序号)
为镁元素的某种粒子结构示意图,该图表示(填序号)
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质、棉花、核酸、PVC、淀粉都是由高分子组成的物质 |
| B、合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
| C、红外光谱仪、核磁共振、质谱仪、分光光度计都可用于有机化合物官能团结构的分析 |
| D、造成大气污染的SO2、CO和NO,主要来源于化石燃料的燃烧和汽车尾气的排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com