
| A. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、I- | |
| B. | 水电离的H+浓度为1×10-13mol•L-1的溶液中,K+、Al3+、Cl-、SO42- | |
| C. | AlO2?浓度为0.1 mol•L-1的溶液中:Na+、K+、HCO3-、Cl- | |
| D. | 加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、NO3- |
分析 A.pH=1的溶液为酸性溶液,硝酸根离子在酸性条件下能够氧化碘离子,铁离子能够氧化碘离子;
B.水电离的H+浓度为1×10-13mol•L-1的溶液中存在大量氢离子或氢氧根离子,铝离子与氢氧根离子反应;
C.碳酸氢根离子与偏铝酸根离子反应生成氢氧化铝沉淀和碳酸根离子;
D.加入KSCN溶液显红色的溶液中存在铁离子,四种离子之间不反应,都不与铁离子反应.
解答 解:A.pH=1的溶液呈酸性,Fe3+能够氧化I-,酸性条件下NO3-、I-之间发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.水电离的H+浓度为1×10-13mol•L-1的溶液中存在大量氢离子或氢氧根离子,Al3+与氢氧根离子反应,在碱性溶液中不能大量共存,故B错误;
C.碳酸氢根离子的酸性大于氢氧化铝,AlO2?、HCO3-之间反应生成氢氧化铝沉淀,故C错误;
D.加入KSCN溶液显红色的溶液中存在铁离子,K+、NH4+、Cl-、NO3-之间不反应,都不与铁离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查了离子共存的判断,题目难度中等,明确题中暗含条件的含义为解答关键,注意掌握离子反应发生条件及离子不能共存的情况,试题培养了学生的灵活运用能力.


科目:高中化学 来源: 题型:选择题
| A. | Fe2+、K+、NO3-、SO42- | B. | Al3+、Na+、HCO3-、SO42- | ||
| C. | NH4+、Al3+、NO3-、Cl- | D. | Na+、Cu2+、S2-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入适量铜粉除去Cu(NO3)2溶液中的AgNO3杂质 | |
| B. | 用NaOH溶液除去CO2中混有的HCl气体 | |
| C. | 稀释浓硫酸时,应将浓硫酸沿器壁慢慢倒入量筒中的水中 | |
| D. | 用乙醇从碘水中萃取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子组成相差1个或若干个CH2原子团的物质互称为同系物 | |
| B. | 相对分子质量相同的有机物是同分异构体 | |
| C. | 分子式相同、结构相同的有机物物理性质和化学性质一定相同 | |
| D. | 碳原子之间只以单键相结合的链烃为烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 用FeS去除废水中的Hg2+:Hg2++S2-═HgS↓ | |
| C. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | KHS溶液中HS-的电离:HS-+H2O?H3O++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
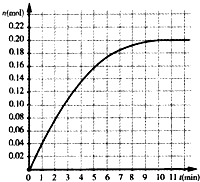 恒温条件下,往容积为2L的密闭容器内加入0.4mol的N2和1.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g),反应中NH3物质的量变化情况如图:下列说法不合理的是( )
恒温条件下,往容积为2L的密闭容器内加入0.4mol的N2和1.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g),反应中NH3物质的量变化情况如图:下列说法不合理的是( )| A. | 其它条件不变,若改用5L容器达到平衡需要的时间将大于10min | |
| B. | N2平衡转化率为25% | |
| C. | 平衡时气体总压强为开始时的90% | |
| D. | 反应前10min反应速率v(H2)=0.01mol?L-1?min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com