
| A. | 参加反应的氧化剂和还原剂的物质的量之比为3:2 | |
| B. | 被氧化和被还原的元素分别为铜和氮 | |
| C. | 当产生0.2 mol气体时,转移电子为0.6 mol | |
| D. | 被还原的CuO占参与反应CuO的$\frac{1}{2}$ |
分析 CuO中的Cu元素由+2价降低为0,NH4Cl中的N元素的化合价由-3价升高为0,由电子守恒、原子守恒可知,NH4Cl失去3个电子,而铜得到2个电子,得失电子守恒,NH4Cl前面系数为2,铜前面的系数为3,再结合原子守恒配平可得4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O,据此对各选项进行判断.
解答 解:Cu由+2价降低为0,N元素的化合价由-3价升高为0,由电子守恒、原子守恒可知,NH4Cl失去3个电子,而铜得到2个电子,得失电子守恒,NH4Cl前面系数为2,铜前面的系数为3,再结合原子守恒配平可得:4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O,
A.根据反应4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O可知,参加反应的氧化剂为氧化铜,还原剂为氯化铵,二者的物质的量之比为3:2,故A正确;
B.氯化铵中N原子化合价升高被氧化,氧化铜中铜元素化合价降低被还原,则被氧化和被还原的元素分别为N和Cu,故B错误;
C.由反应可知,生成1mol气体转移6mol电子,则产生0.2mol的气体转移的电子为0.2mol×6=1.2mol,故C错误;
D.配平的反应为4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O,被还原的氧化铜占参加反应的氧化铜的$\frac{3}{4}$,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,题目难度中等,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查.


科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,粗铜与外接电源的负极相连 | |
| B. | 纯水中c(H+)=5×10-7mol•L-1,则c(OH-)=2×10-8mol•L-1 | |
| C. | CH3COONH4溶液显中性,说明CH3COONH4中的离子均不发生水解 | |
| D. | 向pH和体积均相同的盐酸和醋酸中各加入少量相同质量的锌粉,后者反应速率最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4NO3溶液与氢氧化钠共热:H++OH-═H2O | |
| B. | NH3•H2O滴入AlCl3溶液产生沉淀:3OH-+Al3+═Al(OH)3↓ | |
| C. | NaOH溶液与NaHCO3溶液混合:OH-+H+═H2O | |
| D. | Al(OH)3固体溶于稀硫酸中:Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定 | |
| B. | 500℃、30M Pa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 已知热化学方程式:2SO2(g)+O2?(g) 2SO3(g)△H=-Q kJ/mol,若将一定量的SO2(g)和O2(g)置于密闭容器中充分反应后放出热量Q kJ,则此过程中有2 mol SO2(g)被氧化 | |
| D. | X(g)+Y(g)?Z(g)△H>0,恒温恒容条件下达到平衡后加入X,上述反应△H增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
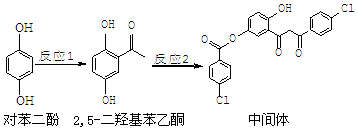
| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1 mol该中间体最多可与11 mol H2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、水解、缩聚反应 | |
| D. | 该中间体分子中含有羰基和烃基两种含氧官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,将0.10mol•L-1的盐酸滴入20mL0.10mol•L-1的氨水中,溶液的pH和pOH随加入盐酸体积变化的曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )
室温下,将0.10mol•L-1的盐酸滴入20mL0.10mol•L-1的氨水中,溶液的pH和pOH随加入盐酸体积变化的曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )| A. | M点所示的溶液中c(NH4+)+c(NH3•H2O)=c(Cl-) | |
| B. | Q点所示的溶液中c(NH4+)>c(Cl-)>c(H+)=c(OH-) | |
| C. | N点所示的溶液中c(NH4+)=c(Cl-) | |
| D. | M点和N点所示的溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上生产玻璃、水泥均需要用石灰石做原料 | |
| B. | 双氧水、高锰酸钾溶液可以杀灭病毒,其消毒原理与二氧化硫漂白丝织物原理相同 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 石油分馏、煤的干馏、海水晒盐、从菜籽中提取菜籽油等过程都是物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com