

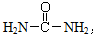 ,请写出尿素的同分异构体中含有离子键的化学式
,请写出尿素的同分异构体中含有离子键的化学式| 一定条件 |
| ||
| ||
| ||
| 催化剂 |
| ||
| 催化剂 |
| 8 |
| 3 |
| 4 |
| 3 |
| 8 |
| 3 |
| 4 |
| 3 |
| 80×100×80% |
| 16 |


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
| A、书写热化学方程式时任何反应条件都不能标注 |
| B、热化学方程式中的化学计量数表示物质的量,可以是分数 |
| C、任何酸与碱发生中和反应,生成1 mol H2O时放出的热量叫做中和热 |
| D、101KPa时,1 mol H2与在足量 O2中燃烧放出的热量就是H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| a |
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图是实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com