
| A.接受H+的能力:CH3COO-> HCO3->ClO- |
B.25℃时,pH=3的硫酸溶液中水的电离程度大于pH=11的氨水溶液中水的电离程 度 度 |
| C.0.1mol/L的(NH4)2CO3溶液中c(NH4+)等于0.1mol/L的NH4Cl溶液中c(NH4+)的2倍 |
| D.四氯化碳分子中的键角大于白磷分子中的键角 |
科目:高中化学 来源:不详 题型:单选题
| A.c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) |
| B.c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
| C.c(Na+)=c(HS-)+2c(H2S)+2c(S2-) |
| D.c(OH-)=c(H+)+c(HS-)+2c(H2S) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol/LNaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
| B.室温下,向0.01mol/LNH4HSO4溶液中滴加等体积0.01mol/LNaOH溶液: c(Na+)=c(SO42-)>c(NH4+).>c(H+)>c(OH-) |
| C.Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) |
| D.25℃时,浓度均为0.1mol/L的CH3COOH和CH3COONa等体积混合: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
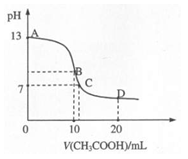
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 )= 。
)= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.在NH4 Cl溶液中加入适量氨水至PH="7" Cl溶液中加入适量氨水至PH="7" |
| B.同物质的量浓度的NH4Cl溶液与HCl液体等体积混合 |
| C.PH=11的氨水与PH=3的HCl溶液等体积混合 |
D.同物质 的量浓度的HCl的溶液与氨水等体积混合 的量浓度的HCl的溶液与氨水等体积混合 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若Va=Vb,则混合后溶液pH=7 |
| B.若Va>Vb,则混合后溶液pH一定小于7 |
| C.若Va=Vb,则盐酸与氨水恰好完全中和 |
| D.若Va=Vb,混合后溶液中微粒浓度的关系可能为: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Fe(OH)3+3HCl若要使FeCl3的水解程
Fe(OH)3+3HCl若要使FeCl3的水解程 度增大,应采取的方法是
度增大,应采取的方法是| A.加入NaHCO3 | B.加入AgNO3 | C.加FeCl3固体 | D.加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com