


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A、元素X和Y可能是同周期元素 |
| B、元素X不可能是ⅡA族元素 |
| C、元素X与氯形成化合物时,化学式可能是XCl |
| D、元素Y在化学性质上与锡相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在25℃,1.01×105Pa时,11.2L氮气所含的原子数目为NA |
| B、48g O3 和O2混合气体所含的原子数目为3NA |
| C、1mol氦气所含的电子数目为4NA |
| D、2.7g金属铝变成铝离子时失去的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用NH3?H2O溶液能鉴别Al3+、Mg2+、Ag+、Cu2+ |
| B、配制一定物质的量浓度的稀H2SO4时,量筒量取浓溶液时若俯视读数,结果偏低 |
C、如图实验 ,关闭弹簧夹,用手捂住烧瓶,长导管下端有气泡冒出,说明气密性良好 ,关闭弹簧夹,用手捂住烧瓶,长导管下端有气泡冒出,说明气密性良好 |
| D、测定中和热时:取25 mL 10 mol/L的浓硫酸和25 mL 10 mol/L的NaOH溶液中和,测定反应放出的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 方案 | 操作 | 实验现象及结论 | 结沦是 否可靠 | 判断依据 |
| 甲 | 取少量黄色溶液,加入四氯化碳,振荡、静置. | 下层溶液呈橙红色,证明Br2不能将Fe2+氧化为Fe3+. | ① | ② (填文字) |
| 乙 | 取少量黄色溶液,加入 几滴淀粉碘化钾溶液. | 溶液变为蓝色,证明Br2能 将Fe2+氧化为Fe3+. | ③ | ④ (写离子方程式) |
| 丙 | 取少量黄色溶液,加入 几滴 ⑤ | 溶液变为红色,证明Br2能 将Fe2+氧化为Fe3+. | 可靠 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
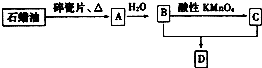 A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,D是具有果香气味的烃的衍生物.A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略).
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,D是具有果香气味的烃的衍生物.A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com