
| A. | Ba(OH)2•8H2O晶体和NH4Cl混合搅拌 | B. | 硫酸与氢氧化钠反应 | ||
| C. | 锌和盐酸反应 | D. | 氢气和氧气的燃烧反应 |
科目:高中化学 来源: 题型:解答题
| 试管编号 | 加3%Na2S2O3溶液/ml | 加H2O/ml | 加H2SO4(1:5)/滴 | 出现浑浊所用时间/s |
| ① | 3 | 3 | 5 | a |
| ② | 4 | 2 | 5 | b |
| ③ | 5 | 1 | 5 | c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VIIA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
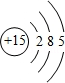 .
.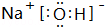 ,其溶于水时破坏的作用力为离子键
,其溶于水时破坏的作用力为离子键查看答案和解析>>
科目:高中化学 来源: 题型:解答题
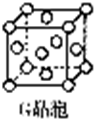 现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.G2E是红色固体.请回答下列问题:
现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.G2E是红色固体.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑧② | B. | ⑥①⑤③ | C. | ④⑤⑨ | D. | ⑦①③⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砹单质是有色固体 | |
| B. | 非金属性:At>I | |
| C. | HAt的稳定性比HI的弱 | |
| D. | I2可以从At的可溶性盐溶液中置换出来At2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅤⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
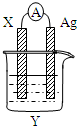 依据氧化还原反应2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.回答下列问题.
依据氧化还原反应2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
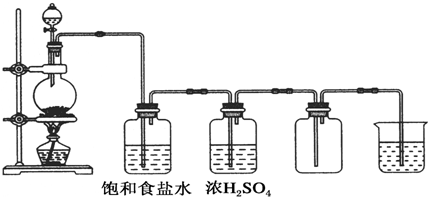
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com