
【题目】下列性质不是萃取剂所具有的是( )
A. 与原溶剂互不相溶 B. 密度一定比原溶剂大
C. 与原溶剂不反应 D. 溶质在萃取剂里的溶解度比在原溶剂中的大
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图1的装置:(以下均假设反应过程中溶液体积不变).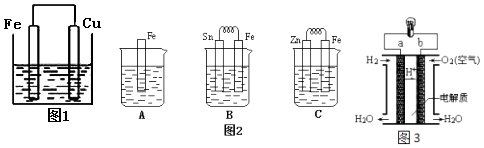
(1)铁片上的电极反应式为 , 铜片周围溶液会出现的现象.
(2)若2min后测得铁片和铜片之间的质量差为1.2g,计算:导线中流过的电子的物质的量为mol;
(3)金属的电化学腐蚀的本质是形成了原电池.如图2所示,烧杯中都盛有稀硫酸.
①图2B中的Sn为极,Sn极附近溶液的pH(填增大、减小或不变) .
②图2C中被腐蚀的金属是 . 比较A,B,C中纯铁被腐蚀的速率由快到慢的顺序是 .
(4)人们应用原电池原理制作了多种电池,以满足不同的需要.燃料电池是一种高效、环境友好的供电装置,如图3是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
①氢氧燃料电池的总反应化学方程式是: .
②电池工作一段时间后硫酸溶液的浓度(填“增大”、“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究生铁与浓硫酸反应所得溶液和气体的成分,他们将一定量的生铁与浓硫酸混合加热,观察到固体完全溶解,并产生大量气体。实验室现有试剂:0.01mol·L-1酸性KMnO4溶液、0.10mol·L-1KI溶液、新制氯水、淀粉溶液、蒸馏水。
一、提出猜想
I.所得溶液中可能含有Fe2+和Fe3+中的一种或两种:
II.所得气体中能闻到刺激性气味,说明气体中肯定含有_________(填分子式)。
二、实验探究
目的 | 实验操作 | 预期现象 | 结论 |
验证I | 步骤①:取少量酸性KMnO4溶液,滴入所得溶液中 | a____________ | 含有Fe2+ |
步骤②:b__________ | C__________________ | 含有Fe3+ | |
验证II | 将所得气体通入如下装置:
| d__________________ | 含有两种或两种以上气体 |
三、问题讨论
(1)有人提出:若选用KSCN溶液和新制氯水就可以完成猜想I的所有探究,这种方法是否可行?_____________(填“可行”或“不可行”)原因是_____________________。
(2)有人提出:试管中的气体可能是H2和X,为此设计了如下实验装置(图中夹持仪器已省略)。
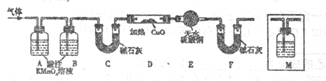
气体X产生的原因是(用化学方程式表示)___________________________________。
②为了验证X的存在,M中盛放的试剂为___________,并将M置于______(选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
③气体中存在X的实验现象是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把4molA和2.5molB混合于2L密闭容器中,发生反应:3A(g)+2B(s)![]() xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol·L-1·min-1,错误的是
xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol·L-1·min-1,错误的是
A. A的平均反应速率为0.15mol·L-1·min-1 B. 平衡时,C的浓度为0.25 mol·L-1
C. B的平均反应速率为0.1mol·L-1·min-1 D. 平衡时,容器内压强为原来的0.875倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)![]() MgO(s)+SO2(g)+ CO2(g) ΔH>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+SO2(g)+ CO2(g) ΔH>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国药学家屠呦呦因发现青蒿素,开创了治疗疟疾的新方法,荣获了诺贝尔奖。已知青蒿素的分子式为C15H22O5。下列有关说法正确的是( )
A. 青蒿素的摩尔质量为282 g·mol-1
B. 青蒿素中C、H、O的质量之比为15∶22∶5
C. 1 mol青蒿素的体积约为22.4 L
D. 1 mol青蒿素中含11 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的CO2分别通入①CaCl2溶液,②澄清石灰水,③Ca(ClO)2溶液,④饱和Na2CO3溶液,最终有沉淀析出的是( )
A. ①②③④ B. ④
C. ①②③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硼镁泥(主要成分为MgSiO3、Fe2O3及少量Al2O3、FeO和MnO)为原料制备高纯Mg(OH)2的流程如下:
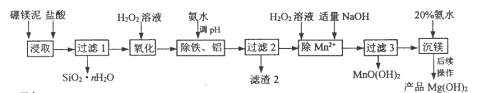
己知:
①常温下此体系中各氢氧化物开始沉淀与沉淀完全时的pH范围如下表所示:
pH值 | Mg(OH)2 | Mn(OH)2 | MnO(OH)2 | Fe(OH)2 | Al(OH)3 | Fe(OH)3 |
开始沉淀时 | 9.3 | 7.1 | 7.8 | 7.6 | 3.7 | 2.3 |
沉淀完全时 | 10.8 | 10.8 | 9.8 | 9.6 | 4.7 | 3.7 |
②温度高于340℃时Mg(OH)2开始分解为MgO和H2O。
(1)“浸取”时,为提高镁的浸取率可行的措施为__________。
a.将硼镁泥制成浆料 b.降低浸取温度 c.用盐酸多次浸取
(2)“浸取”时,MgSiO3与盐酸反应的化学方程式为_________________________。
(3)“除铁、铝”时,需调节溶液pH范围为_________________________。
(4)“除Mn2+”时发生反应的离子方程式为_________________________;
过滤3所得滤渣中含有MnO(OH)2和__________。
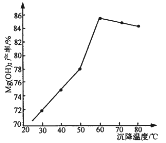
(5)“沉镁”时,反应温度与Mg(OH)2的产率如图所示,当温度超过60℃,随温度再升高,Mg(OH)2产率反而降低,其原因可能是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com