
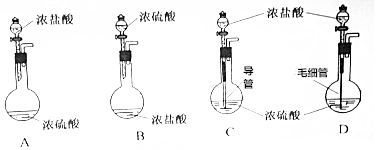
分析 (1)浓硫酸具有吸水性,溶于水产生大量的热,浓盐酸易挥发,据此分析解答;
(2)固体氯化钠与浓硫酸在加热条件下反应生成氯化氢、硫酸钠;
解答 (1)浓硫酸具有吸水性,溶于水产生大量的热,浓盐酸易挥发,浓硫酸密度大于盐酸,稀释时放出大量的热,所以用浓硫酸与浓盐酸制取干燥的HCl,应将浓硫酸滴加到浓盐酸中,应选择装置:B;
故答案为:B;
(2)固体氯化钠与浓硫酸在加热条件下反应生成氯化氢、硫酸钠,化学方程式:2 NaCl+H2SO4 $\frac{\underline{\;加热\;}}{\;}$ Na2SO4 +2 HCl↑;
故答案为:2 NaCl+H2SO4 $\frac{\underline{\;加热\;}}{\;}$ Na2SO4 +2 HCl↑.
点评 本题考查了氯化氢的制备,明确浓硫酸、浓盐酸的性质是解题关键,注意浓硫酸稀释的正确操作,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | pH=1的溶液:K+、Na+、F-、Br- | |
| D. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| 盐酸液的体积(mL) | 30 | 30 | 30 | 30 |
| 样品(g) | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积(mL) | 672 | 840 | 896 | 672 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
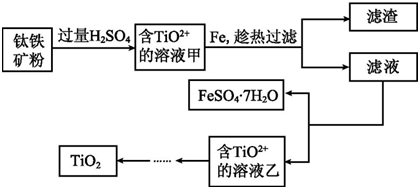
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
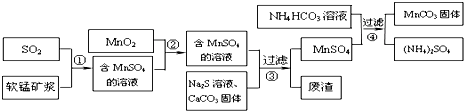
| 物质 | MnS | CuS | PbS |
| Ksp | 2.5×10-13 | 6.3×10-36 | 8.0×10-28 |
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com