
【题目】[化学--选修5:有机化学基础]
氰基丙烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:

已知:
①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②
回答下列问题:
(1)A的化学名称为_______。
(2)B的结构简式为______,其核磁共振氢谱显示为______组峰,峰面积比为______。
(3)由C生成D的反应类型为________。
(4)由D生成E的化学方程式为___________。
(5)G中的官能团有___、 ____ 、_____。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____种。(不含立体异构)
【答案】(1)丙酮
(2)![]() 2 6:1
2 6:1
(3)取代反应
(4)![]()
(5)碳碳双键 酯基 氰基
(6)8
【解析】
试题A的相对分子质量为58,氧元素质量分数为0.276,则A分子中氧原子数目为![]() =1,分子中C、H原子总相对原子质量为58-16=42,则分子中最大碳原子数目为
=1,分子中C、H原子总相对原子质量为58-16=42,则分子中最大碳原子数目为![]() =3…6,故A的分子式为C3H6O,其核磁共振氢谱显示为单峰,且发生信息中加成反应生成B,故A为
=3…6,故A的分子式为C3H6O,其核磁共振氢谱显示为单峰,且发生信息中加成反应生成B,故A为![]() ,B为
,B为 ;B发生消去反应生成C为
;B发生消去反应生成C为![]() ;C与氯气光照反应生成D,D发生水解反应生成E,结合E的分子式可知,C与氯气发生取代反应生成D,则D为
;C与氯气光照反应生成D,D发生水解反应生成E,结合E的分子式可知,C与氯气发生取代反应生成D,则D为![]() ;E发生氧化反应生成F,F与甲醇发生酯化反应生成G,则E为
;E发生氧化反应生成F,F与甲醇发生酯化反应生成G,则E为![]() ,F为
,F为![]() ,G为
,G为![]() 。
。
(1)由上述分析可知,A为![]() ,化学名称为丙酮。
,化学名称为丙酮。
故答案为:丙酮;
(2)由上述分析可知,B的结构简式为 其核磁共振氢谱显示为2组峰,峰面积比为1:6。
其核磁共振氢谱显示为2组峰,峰面积比为1:6。
故答案为: ;1:6;
;1:6;
(3)由C生成D的反应类型为:取代反应。
故答案为:取代反应;
(4)由D生成E的化学方程式为![]() +NaOH
+NaOH![]()
![]() +NaCl。
+NaCl。
故答案为:![]() +NaOH
+NaOH![]()
![]() +NaCl;
+NaCl;
(5)G为![]() ,G中的官能团有酯基、碳碳双键、氰基。
,G中的官能团有酯基、碳碳双键、氰基。
故答案为:酯基、碳碳双键、氰基;
(6)G(![]() )的同分异构体中,与G具有相同官能团且能发生银镜反应,含有甲酸形成
)的同分异构体中,与G具有相同官能团且能发生银镜反应,含有甲酸形成
的酯基:HCOOCH2CH=CH2、HCOOCH=CHCH3、HCOOC(CH3)=CH2,当为HCOOCH2CH=CH2时,-CN的取代位置有3种,当为HCOOCH=CHCH3时,-CN的取代位置有3种,当为HCOOC(CH3)=CH2时,-CN的取代位置有2种,共有8种。
故答案为:8。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为部分短周期非金属元素的性质或原子结构,已知A﹣D的原子序数依次增大。
元素编号 | 元素性质或原子结构 |
A | A原子所处的周期数、族序数、原子序数均相等 |
B | 核外电子有6种不同运动状态 |
C | 最简单氢化物的水溶液呈碱性 |
D | 基态原子的s轨道电子数等于p轨道电子数 |
请结合表中信息完成下列各小题(答题时用所对应的元素符号):
(1)写出C原子的电子排布图________。
(2)A,B,C,D的第一电离能由大到小的顺序为________。
(3)用电离方程式表示C的最简单氢化物的水溶液呈碱性的原因________。按照共价键理论,分子中每个原子的最外电子层电子数均已饱和,已知ABCD分子可能有三种不同结构,它们的结构可以从其他物质的结构中获得启发。
(4)ABC的结构式是______,向其中插入一个D原子,若形成配位键(用→表示)则ABCD的结构式为_______,分子中C的原子的杂化类型是______;若无配位键则ABCD的结构式为______分子中D原子的杂化类型为________。
(5)BD2的电子式是________将D原子换成等电子的 ![]() 所得ABCD的结构式为_______,分子中C原子的杂化类型是_______。
所得ABCD的结构式为_______,分子中C原子的杂化类型是_______。
(6)在ABCD的三种可能结构中B原子的杂化类型________(填“相同”或“不相同”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果。

实验Ⅰ
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
(NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是_______(用化学用语表示)。溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”) 。
(2)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行实验Ⅱ,否定了该观点,补全该实验。
操作 | 现象 |
取_______,加_______,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(3)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验Ⅲ:分别配制0.80 mol·L-1 pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应 4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+
4Fe(OH)3+8H+
由实验III,乙同学可得出的结论是_______,原因是_______。
(4)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是_____。
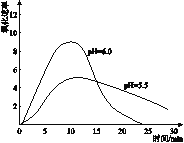
(5)综合以上实验,增强Fe2+稳定性的措施有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元弱碱B(OH)2(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀B(OH)2溶液中滴加等浓度盐酸,B(OH)2、B(OH)+、B2+的浓度分数![]() 随溶液pOH[pOH=-lgc(OH-)]变化的关系如图,以下说法正确的是
随溶液pOH[pOH=-lgc(OH-)]变化的关系如图,以下说法正确的是
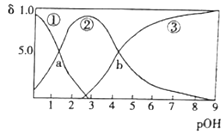
A.交点a处对应加入的盐酸溶液的体积为5mL
B.当加入的盐酸溶液的体积为10mL时存在c(Cl-)>c(B(OH)+)>c(H+)>c(OH-)>c(B2+)
C.交点b处c(OH-)=6.4×l0-5
D.当加入的盐酸溶液的体积为15mL时存在:c(Cl-)+c(OH-)>c(H+)>c(OH-)>c(B2+)+ c(B(OH)+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.0.1mol苯中含有的碳碳双键数为0.3NA
B.1molNO2与足量H2O反应,转移的电子数为NA
C.标准状况下,11.2L CO和CO2混合物含有碳原子数为0.5NA
D.密闭容器中,1 molN2与4molH2充分反应生成的NH3分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系。
(1)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJmol-1)
化学键 | H-H | Cl-Cl | H-Cl |
键能/(kJmol-1) | 436 | 243 | 431 |
根据以上信息可知,1molH2在足量的氯气中燃烧生成氯化氢气体放出的热量是_______
(2)工业上有一种方法是用CO2来生产燃料甲醇,可以将CO2变废为宝。在体积为1L的密闭容器中充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:

①从反应开始到平衡,CH3OH的平均反应速率υ(CH3OH)=_______________。
②若反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
A.υ(CO2)=0.15molL-1min-1 B.υ(H2)=0.01molL-1s-1
C.υ(CH3OH)=0.2molL-1min-1 D.υ(H2O)=0.45molL-1min-1
该反应进行由快到慢的顺序为___________(填字母)
(3)海水化学资源的利用具有非常广阔的前景,从海水中提取溴的工业流程如图所示:

①以上五个过程中涉及氧化还原反应的有_____________个。
②步骤③中已获得游离态的溴,步骤④又随之转变成化合态的溴,其目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键的断裂和新键的形成过程。化学键的键能是形成化学键时释放的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198P—O:360O=O:498,则反应P4(白磷)+3O2=P4O6的反应热ΔH为 ( )

A. -1638 kJ·mol-1B. +1638 kJ·mol-1C. -126 kJ·mol-1D. +126 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com