
【题目】某校课外探究小组欲在实验室条件下制取少量纯净的无水氯化铝。查阅到以下资料:无水氯化铝是白色晶体,易吸收水分,常压下在177.8 ℃升华,遇潮湿空气即产生大量白雾。用于有机合成和石油工业的催化剂,以及用于处理润滑油等。他们设计了以下装置,请结合题意回答问题:

(1)A装置中发生反应的化学方程式为:_________________________
(2)装置B的作用是__________________________
(3)请给标记为F的实线方框选择合适的装置_______

(4)AlCl3遇潮湿空气即产生大量白雾的原因是_________________(结合化学方程式说明)。
(5)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案。方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定。实验中所用NaOH溶液浓度为0.2000 mol·L-1,以下是实验记录与数据处理(不考虑NaOH与残液中其他成分的反应)。
①若本实验需要NaOH标准溶液80mL,则配制该标准溶液需要用到玻璃仪器有玻璃棒,烧杯_______
②经计算,该次滴定测的试样中盐酸浓度为_______________mol·L-1。
③在本实验的滴定过程中,下列操作会使实验结果偏小的是___________(填写序号)。
A.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失
B.未用标准NaOH溶液润洗滴定管
C.锥形瓶中加入待测盐酸后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前锥形瓶用待测盐酸润洗
f.观察读数时,滴定前仰视,滴定后俯视
【答案】(1)MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(2)除去氯气中混有的氯化氢气体
(3)Ⅲ(4)氯化铝易水解,发生如下反应:AlCl3+3H2O![]() Al(OH)3+3HCl,产生的氯化氢气体在空气中形成酸雾
Al(OH)3+3HCl,产生的氯化氢气体在空气中形成酸雾
(5)①胶头滴管 100mL容量瓶 ②0.2200(保留4位有效数字) ③ d f
【解析】
试题分析:(1)A装置原来制备氯气,其中发生反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑。
MnCl2+2H2O+Cl2↑。
(2)浓盐酸易挥发,生成的氯气中含有氯化氢气体会干扰后续的反应,所以装置B的作用是除去氯气中混有的氯化氢气体;
(3)氯气有毒,需要尾气处理,一般用氢氧化钠溶液。又因为无水氯化铝是白色晶体,易吸收水分,常压下在177.8℃升华,遇潮湿空气即产生大量白雾,所以还必须防止空气中的水蒸气进入,所以需要利用浓硫酸吸收空气中的水蒸气,则选择装置Ⅲ;
(4)由于氯化铝易水解,可发生如下反应:AlCl3+3H2O![]() Al(OH)3+3HCl,产生的氯化氢气体在空气中形成酸雾,从而产生大量白雾;
Al(OH)3+3HCl,产生的氯化氢气体在空气中形成酸雾,从而产生大量白雾;
(5)①本实验需要NaOH标准溶液80mL,则配制该标准溶液需要用到玻璃仪器有玻璃棒,烧杯、胶头滴管、100mL容量瓶;
②四次实验中消耗氢氧化钠溶液的体积分别是22.60ml、21.99ml、22.01ml、22.00ml,这说明第一次实验中误差太大,舍去,则消耗氢氧化钠溶液体积的平均值是(21.99ml+22.01ml+22.00ml)÷3=22.00ml,因此盐酸的浓度是(0.2000mol/L×22.00ml)÷20.00ml=0.2200mol/L。
③a.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失,则导致消耗氢氧化钠溶液的体积增加,测定结果偏高;b.未用标准NaOH溶液润洗滴定管,相当于稀释,则导致消耗氢氧化钠溶液的体积增加,测定结果偏高;c.锥形瓶中加入待测盐酸后,再加少量水,不会影响测定结果;d.锥形瓶在滴定时剧烈摇动,有少量液体溅出,溶质氯化氢减少,导致消耗氢氧化钠溶液的体积减少,测定结果偏小;e.滴定前锥形瓶用待测盐酸润洗,则导致消耗氢氧化钠溶液的体积增加,测定结果偏高;f.观察读数时,滴定前仰视,读数偏大,滴定后俯视读数偏小,则导致消耗氢氧化钠溶液的体积减少,测定结果偏小,答案选df。


科目:高中化学 来源: 题型:
【题目】用下列实验或实验装置进行的实验中,能达到相应实验目的的是( )

A.装置甲:防止铁钉生锈
B.测定同温同浓度的NaCl和NaF溶液的pH,确定F、Cl两元素的非金属性的强弱
C.装置乙:除去甲烷中混有的乙烯
D. 用Ca(OH)2溶液来鉴别Na2CO3溶液和NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于食品添加剂的叙述中不正确的是( )
A.醋可同时用作防腐剂和调味剂 B.亚硝酸钠可生成致癌物质
C.我国应该禁止使用味精 D.苯甲酸钠可用作食品的防腐剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
⑴ Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是_______。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
⑵ Li4SiO4可用于吸收、释放CO2,原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生。写出CO2与Li4SiO4反应的化学方程式 ;该反应为_______(填“吸”或者“放”)热反应,原因是 _____________。
⑶ CO与H2在催化剂作用下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)。对此反应进行如下研究:某温度下在某2 L恒容密闭容器中分别充入1.2 mol CO和1 mol H2,达到平衡测得有0.4 mol CH3OH(g),则该反应平衡常数值为_______。
CH3OH(g)。对此反应进行如下研究:某温度下在某2 L恒容密闭容器中分别充入1.2 mol CO和1 mol H2,达到平衡测得有0.4 mol CH3OH(g),则该反应平衡常数值为_______。
⑷ 在200℃并用钴做催化剂的条件下,CO与H2可合成C5H12(汽油的一种成分),可减少碳排放。反应中能量变化如下图所示,写出该反应的热化学方程式______________。

⑸ 如下图所示,利用缺铁氧化物[如Fe0.9O]可实现CO2的综合利用、构建低碳环保社会。请说明该转化的优点_____________________。
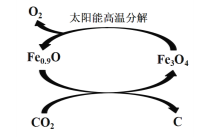
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:150 ℃时, NO2发生分解反应2NO2(g)![]() 2NO(g)+O2(g) ΔH>0。向容积为1 L的密闭容器中通入0.05 mol NO2,在150 ℃时充分反应,达到平衡后测得c(NO)=0.04 mol/L。
2NO(g)+O2(g) ΔH>0。向容积为1 L的密闭容器中通入0.05 mol NO2,在150 ℃时充分反应,达到平衡后测得c(NO)=0.04 mol/L。
(1)能说明上述反应已经达到平衡状态的是________(填字母)。
A.容器内气体的颜色不再变化
B.容器内压强不再变化
C.容器内气体的密度不再变化
D.容器内气体的平均摩尔质量不再变化
E.v逆(NO2)=v正(NO)
F.相同时间内,每消耗2个NO2分子,即可生成2个NO分子
(2)150 ℃时上述反应的平衡常数K=________(填数值)。
(3)下列有关该反应的图像中正确的是__________(填字母)。

(4)发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知: N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ/mol。[来源则N2H4(g)和NO2反应的热化学方程式为___________________________。
(5)若向500 mL 0.1 mol/L的CH3COONa溶液中加入250mL 0.1 mol/L的HNO3,此时溶液显酸性,则所得混合溶液中离子浓度的大小顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
①用50 mL量筒量取5.2 mL稀硫酸;
②用分液漏斗分离苯和四氯化碳的混合物;
③用托盘天平称量17.7 g氯化钠晶体;
④向小试管中加入100ml稀盐酸。
A. ①② B. ②③ C. ③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A.第二次平衡时,Z的浓度为0.4 mol·L -1
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.m=2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com