
| 选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子的立体构型 |
| A | SO2 | sp | 直线形 | 直线形 |
| B | HCHO | sp2 | 平面三角形 | 三角锥形 |
| C | NF3 | sp2 | 四面体形 | 平面三角形 |
| D | NH4+ | sp3 | 正四面体形 | 正四面体形 |
| A、A | B、B | C、C | D、D |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
 在密闭容器中,一边装有一定量的金属钠,一边装有一定量的氧化汞,同时加热容器的两部分,钠和氧化汞都完全反应后,恢复到原温度,容器内空气的成分仍不变.则钠和氧化汞的物质的量之比是
在密闭容器中,一边装有一定量的金属钠,一边装有一定量的氧化汞,同时加热容器的两部分,钠和氧化汞都完全反应后,恢复到原温度,容器内空气的成分仍不变.则钠和氧化汞的物质的量之比是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu+2Fe3+═Cu2++2Fe2+ |
| B、10 Cl-+2 MnO4-+16 H+═2 Mn2++5Cl2+8H2O |
| C、2 Fe2++Cl2═2 Fe3++2Cl- |
| D、5 Pb2++2MnO4-+2 H2O═5 PbO2+2 Mn2++4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 金属/mol | 酸的浓度及体积 | 反应温度 | |
| A | 铝粉0.1 | 8mol?L-1硝酸10mL | 30℃ |
| B | 铝粉0.1 | 3mol?L-1盐酸10mL | 25℃ |
| C | 铝粉0.1 | 3mol?L-1硫酸 10mL | 25℃ |
| D | 铝片 0.1 | 3mol?L-1硫酸10mL | 25℃ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯、聚乙烯、聚苯乙烯都是不饱和烃 |
| B、石油的分馏、煤的液化都是物理变化 |
| C、天然气是不可再生的能源,而沼气是可再生的生物质能 |
| D、苯可在FeBr3作催化剂时与溴水发生取代反应,从而使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同 


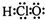
 的名称为:1,3-二甲基-2-丁烯
的名称为:1,3-二甲基-2-丁烯| A、①②④⑥ | B、①④⑤⑧ |
| C、①②⑤⑧ | D、②③⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com