
【题目】(一)铅蓄电池是典型的二次电池,电池总反应式为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________________________。当外电路通过1 mol电子时,理论上负极板的质量增加______g。
2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________________________。当外电路通过1 mol电子时,理论上负极板的质量增加______g。
(二)某研究性学习小组,为了探究电极与原电池的电解质之间关系,设计了下列实验方案:用铝片、铜片、镁片作电极,分别与下列溶液构成原电池,并接电流表。
(1)若用HNO3(浓)作电解质溶液,电极为铜片和铝片,正极上发生的电极反应式为________________;
(2)若电解质溶液为0.5mol/LNaOH溶液,电极为镁片和铝片,则负极的电极反应式为____________。
【答案】PbO2+2e-+4H++SO42-=PbSO4+2H2O 48 NO3-+e-+2H+=NO2↑+H2O Al-3e- +4OH- =[Al(OH)4]-
【解析】
(一)该铅蓄电池中放电时,正极反应式为PbO2+2e-+SO42-+4H+=PbSO4(s)+2H2O、负极反应式为Pb-2e-+SO42-=PbSO4;据此分析解答;
(二)(1)在浓硝酸中,铝遇浓硝酸发生钝化,铜溶解,所以铜易失电子为负极,铝是正极;
(2)在氢氧化钠溶液中镁不失去电子,而铝失去电子作负极,镁作正极。
(一)该铅蓄电池中放电时,正极反应式为PbO2+2e-+SO42-+4H+=PbSO4(s)+2H2O、负极反应式为Pb(s)-2e-+SO42-(aq)=PbSO4(s),2e-~Pb~PbSO4~△m=96g ,因此当外电路通过1 mol电子时,理论上负极板的质量增加96g×![]() =48g;
=48g;
答案:PbO2+2e-+4H++SO42-=PbSO4+2H2O;48;
(二)(1)该原电池中,铝和浓硝酸发生钝化现象而阻止进一步反应,铜和浓硝酸反应,所以铜失电子而作负极,铝作正极,铜电极上失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,正极上硝酸根离子得电子生成二氧化氮,电极反应式为:NO3-+e-+2H+=NO2↑+H2O;
答案:NO3-+e-+2H+=NO2↑+H2O;
(2)该原电池中,铝易失电子而作负极,镁作正极,正极上水得电子生成氢氧根离子和氢气,电极反应式为:2H2O+2e-=2OH-+H2↑,负极上铝失电子生成[Al(OH)4]-,电极反应式为Al-3e- +4OH- =[Al(OH)4]-;
答案:Al-3e- +4OH- =[Al(OH)4]-。


科目:高中化学 来源: 题型:
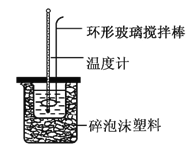
【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1NaOH溶液和如图所示装置,进行测定中和热的实验,得到下表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是_________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是__________。
(3)根据上表中所测数据进行计算,则该实验测得的中和热ΔH=__[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。如果用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将_______(填“偏大”、“偏小”或“不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是_________。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应:2A(g)+3B(g)![]() xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是( )
xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是( )
A. 2min末时A和B的浓度之比为5:3
B. x=1
C. 2min末时B的浓度为1.5mol/L
D. 2min末时A的消耗浓度为0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年5月7日,天津某工程检测公司在进行探伤作业期间,一枚黄豆粒大小的放射源铱-192丢失,造成了严重的安全事故,图示是铱在元素周期表中的信息,下列说法正确的是( )
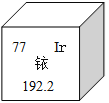
A. 铱的相对原子质量为192.2克
B. 铱原子核内的中子数为77
C. K2IrO3中Ir的化合价为+4
D. 生活中常用的铱金笔为纯净的铱单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真观察下列装置,下列说法错误的是
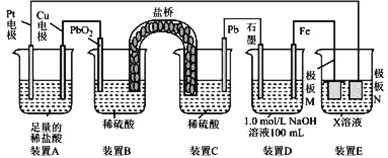
A.盐桥中的阳离子向装置B移动
B.装置A中总反应的离子方程式为 Cu+2H+ ![]() Cu2++H2 ↑
Cu2++H2 ↑
C.若在装置 D 中生成 0. 2 mol Fe(OH)3,则消耗水的物质的量共为0. 5mol
D.若装置E的目的是在Cu材料上镀银,则极板 N 的材料为Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对应的离子方程式正确的是( )
A.酸性高锰酸钾溶液和草酸溶液反应:2![]() +16H++5
+16H++5![]() ═2Mn2++10CO2↑+8H2O
═2Mn2++10CO2↑+8H2O
B.向氯化铁溶液中通入过量二氧化硫:2Fe3++3SO2+6H2O═2Fe+3![]() +12H+
+12H+
C.银和稀硝酸反应:3Ag+4H++![]() ═3Ag++2H2O+NO↑
═3Ag++2H2O+NO↑
D.向氯水中加入碳酸钠:Cl2+![]() ═Cl-+ClO-+CO2↑
═Cl-+ClO-+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2)为原料制备硫酸亚铁晶体(FeSO4xH2O)的工艺流程如下:
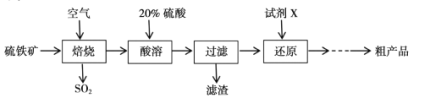
(1)已知焙烧后得到的固体主要成分为Fe2O3。写出焙烧过程主要反应的化学方程式____。
(2)写出酸溶过程主要反应的离子方程式____。
(3)试剂X是(写化学式)____。
(4)从还原得到的溶液中获得硫酸亚铁晶体(FeSO4xH2O)的操作是____
(5)利用如图装置测定FeSO4xH2O中结晶水含量:
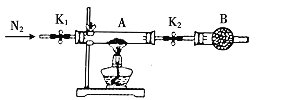
实验前通入N2,的主要目的是____,装置B中盛放的试剂是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红矾钠(重铬酸钠:![]() )是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
)是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
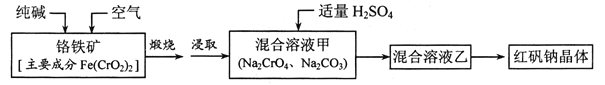
请回答下列问题:
(1)![]() 的基态电子排布式为____________。
的基态电子排布式为____________。
(2)锻烧铬铁矿发生反应:____________Fe(CrO2)2+Na2CO3+O2![]() Fe2O3+Na2CrO4+CO2 配平上述化学反应方程式。
Fe2O3+Na2CrO4+CO2 配平上述化学反应方程式。
(3)溶液甲中加入H2SO4时,可以观察到溶液由黄色变为橙色,并放出无色气体,有关反应的离子方程式为____________。
(4)制备红矾钠的废水必须进行处理。首先酸化废水,将含+6价铬的酸性废液放入电解槽内,用铁作阳极进行电解,阴极析出H2,阳极产物被![]() 氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
①阳极的电极反应式为(不考虑后续反应):____________。
②溶液中金属离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因:______。
③已知某含![]() 的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要95 mL l.0 mol/L稀硫酸,现用98%的浓硫酸(其密度为1.84 g.mL-l)来配制。
(1)实验需要的玻璃仪器有50 mL烧杯、玻璃棒、胶头滴管、____、____。
(2)玻璃棒的作用为____,胶头滴管的作用为________,
(3)配制过程中,下列情况会使配制结果偏低的是(填序号)____。
A.将稀释的硫酸液转移至容量瓶后,洗涤烧杯和玻璃棒2-3次。
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。
C.容量瓶使用时未干燥。
D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度相切。
E.未冷却至室温就定容。
F.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com