
写出适当的计算过程
(1)右图是硫酸试剂瓶标签上的部分说明文字。
试计算:该硫酸溶液中H2SO4的物质的量浓度是多少?
(2)将上述浓硫酸加水稀释至2mol·L-1 ,取50 mL该稀硫酸溶液与足量的锌粉反应,则标准状况下生成氢气体积为多少L?
 (3)请认真阅读下面某矿泉水标签内容,计算:
(3)请认真阅读下面某矿泉水标签内容,计算:
该矿泉水中镁离子的物质的量浓度的最大值为多少?

 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
下列各组物质的性质比较中不正确的是
A.热稳定性:SiH4>PH3>H2S B.酸性:HClO4>H2SO4>H3PO4
C.碱性:NaOH>Mg(OH)2>Al(OH)3 D.氧化性:F2>Cl2>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1) (2分)硫酸铜溶液可以加快氢气生成速率的原因
。
(2) (1分)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是 。
(4) (2分)要加快上述实验中气体产生的速率,还可采取的措施有(答两种):
;
。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是
A.18 g水中所含的电子数为10NA
B.在标准状况下,1mol水的体积约为22.4L
C.0.3 mol·L-1Na2SO4溶液中含0.6NA个Na+
D.11.2L氮气中含NA个氮原子
查看答案和解析>>
科目:高中化学 来源: 题型:
往100 mL 4mol/L的AlCl3溶液中滴加2mol/L的NaOH溶液,得到23.4g沉淀,则加入NaOH溶液的体积可能是
A、300 mL B、400mL C、600 mL D、650 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应的描述中正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.已知NaOH(aq) +HCI(aq) =NaCI(aq)+H2O(1) △H=-57.3 kJ·mol-1,
则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量
C. CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为
2CO(g)+O2(g)=2CO2(g) △H=-283.0 kJ·mol-1
D.已知2C(s) +2O2(g)=2CO2(g) △H=a,2C(s) +O2(g)=2CO(g) △H=b,则b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
用一定量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
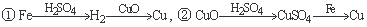
若按实验原则进行操作,则两者制得单质铜的量的比较正确的是( )
A.①多 B.②多 C.相等 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
我国某大城市今年夏季多次降下酸雨。据环保部门测定,该城市整个夏季酸雨的pH平均为3.2,在这种环境中的铁制品极易被腐蚀。对此条件下铁的腐蚀的叙述不正确的是:
|
| A. | 此腐蚀过程有化学腐蚀也有电化学腐蚀 |
|
| B. | 发生电化学腐蚀时的正极反应为 2H2O+O2+4e﹣═ 4OH﹣ |
|
| C. | 在化学腐蚀过程中有氢气产生 |
|
| D. | 发生电化学腐蚀时的负极反应为Fe﹣2e﹣═ Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)上述八种元素中,最高价氧化物水化物酸性最强的化合物的化学式是 ,(填化学符号,下同),最高价氧化物水化物碱性最强的化合物的化学式是 ,最高价氧化物水化物显两性的氢氧化物的化学式是 。
(2)③与④的气态氢化物的稳定性由大到小的顺序是 。
(3)④、⑤、⑥的离子半径由大到小的顺序是__________________。
(4)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是______________。
(5)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
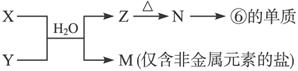
X溶液与Y溶液反应的离子方程式为______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com