
 蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 3.3 | 9.4 |
| 完全沉淀的pH | 3.7 | 5.2 | 11.0 |


科目:高中化学 来源: 题型:
 (2013?广东模拟)蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
(2013?广东模拟)蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 3.3 | 9.4 |
| 完全沉淀的pH | 3.7 | 5.2 | 11.0 |
查看答案和解析>>
科目:高中化学 来源:2013届广东省六校高三第一次联考化学试卷(带解析) 题型:实验题
(10分)蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成。实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 3.3 | 9.4 |
| 完全沉淀的pH | 3.7 | 5.2 | 11.0 |

查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省六校高三第一次联考化学试卷(解析版) 题型:实验题
(10分)蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成。实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀的pH |
1.5 |
3.3 |
9.4 |
|
完全沉淀的pH |
3.7 |
5.2 |
11.0 |
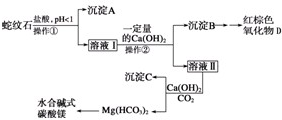
实验步骤如下:

⑴ 实验室完成操作①所用到的玻璃仪器有:_______________________________。
⑵ 操作②中应控制溶液pH的合理范围是___________(填序号)。
A. 小于1.5 B. 1.5~3.3 C. 7~8 D. 大于9.4
⑶ 检验溶液Ⅱ中是否含有Fe3+的操作与结论是:_____________________________________
⑷ 从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为:_______________________________,再进行____________、洗涤 、___________(依次填写实验操作名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com