
【题目】amL三种气态烃组成的混合物与足量氧气反应,恢复到原来的状态,体积共缩小2amL,则这三种烃可能是( )
A. CH4、C2H4、C3H4 B. C2H6、C3H6、C4H6 C. CH4、C2H6 C3H8 D. CH4、C2H4、C2H2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用以下三种途径制取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成氧化铜,氧化铜再与稀硝酸反应.下列叙述不正确的是( )
A.对环境造成的危害:③最小
B.所消耗的硝酸的物质的量:①>②>③
C.三种途径所消耗的铜的质量相同
D.铜与浓硝酸反应速率最快,故制取硝酸铜最佳方案是①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下将l0mL c(H+)=0.00lmol/L的醋酸溶液加水稀释10倍后,下列说法正确的是( )
A. 醋酸的电离程度增大,c(H+)亦增大
B. 溶液中 不变
不变
C. 溶液中导电粒子的数目增多
D. 再加入l0mL c(OH-)=0.00lmol/L的NaOH溶液,混合液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
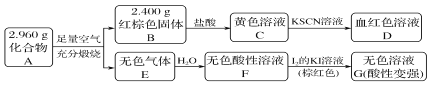
请回答:
(1)A的组成元素为________(用元素符号表示),化学式为_____________________。
(2)溶液C可溶解铜片,例举该反应的一个实际应用________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为________。写出该反应的离子方程式____________________。
写出F→G反应的化学方程式___________________________________。
设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-) _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确写出下列反应的化学方程式:
(1)Al(OH)3 与氢氧化钠溶液反应:
(2)氢氧化亚铁被氧化成氢氧化铁:
(3)二氧化硅与氢氟酸反应:
(4)氨气的实验室制取法:
(5)浓硫酸与木炭反应:
(6)稀硝酸与铜反应: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率的说法正确的是 ( )
A. 升高温度可降低化学反应的活化能,使化学反应速率提高
B. 在温度、体积都相同的两容器中,分别充入相同物质的量的Br2和Cl2,让它们与等量的氢气发生反应,反应速率相同
C. 0.1 mol·L-1盐酸和0.1 mol·L-1硝酸与相同形状和大小的大理石反应的速率相同
D. 有气体参加的化学反应,若增大压强(即缩小反应容器的容积),可增加活化分子的百分数,从而使反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学实验说法正确的是( )
A.用磨口玻璃塞的细口瓶盛放Na2CO3溶液
B.用酸式滴定管量取20.00 mL硫酸
C.电镀时,通常把镀层金属作阴极
D.中和反应反应热的测定实验中用到的所有玻璃仪器为烧杯、量筒、温度计
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4 -+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。某实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20mL 0.lmol·L-l H2C2O4溶液 | 30mL 0.01mol.L-l KMnO4溶液 |
② | 20mL 0.2mol·L-l H2C2O4溶液 | 30mL 0.01mol.L-l KMnO4溶液 |

(1)该实验探究的是______对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是_____(填实验序号)。
(2)若实验①在2min末注射器的活塞向右移动到了b mL的位置,则这段时间的反应速率可表示为v(CO2)=______mL/min。若实验②在t min收集了4.48×10-3L CO2(标准状况下),则t min末c(MnO4-)=______。
(3)该小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是:①___________、②___________。
(4)已知草酸是一种二元弱酸,其电离常数K1=5.4×10-2、K2=5.4×10-5,写出草酸的电离方程式_______、________。试从电离平衡移动的角度解释K1>>K2的原因_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com