
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
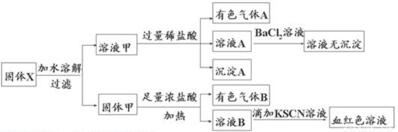
| A. | 溶液甲中一定含有K2SO3、NaNO2 | B. | 无法判断溶液中是否有K2SO3 | ||
| C. | 气体A和气体B-定为混合物 | D. | 原混合物中一定有Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的NaOH溶液与0.1 mol/L的CH3COOH溶液等体积混合c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | 常温下,0.01 mol/L的NaOH溶液与pH=2的CH3COOH溶液等体积混合c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 常温下,0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液混合后使pH=7,c(CH3COO-)═c(Na+)>c(H+)=c(OH-) | |
| D. | 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)═c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中c(Na+)=0.2 mol•L-1 | |
| B. | 电解后溶液中c(H+)=0.4mol•L-1 | |
| C. | 上述电解过程中共转移0.4 mol电子 | |
| D. | 电解后得到的Cu的物质的量为0.05mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也无同分异构体 | |
| B. | 淀粉、油脂、蛋白质、纤维素都能在人体内水解,也能在体内氧化提供能量 | |
| C. | 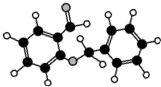 如图所示的有机物分子式为C14H12O2,能发生银镜反应 | |
| D. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
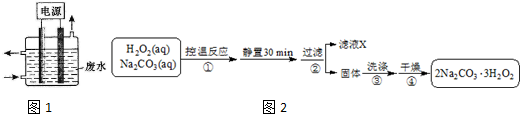
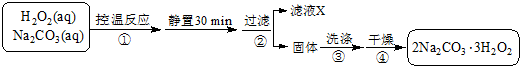
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=12的溶液中:K+、Cl-、HCO3-、Na+ | |
| B. | 在[H+]=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| C. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| D. | 使石蕊试液变红的溶液:K+、MnO4-、I-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
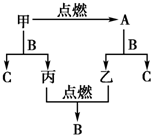 A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.
A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质在反应中失去电子,该物质是氧化剂 | |
| B. | 置换反应一定属于氧化还原反应 | |
| C. | 氧化还原反应的本质是元素化合价的升降 | |
| D. | 发生反应时,电子不可以在同种元素间转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com