
【题目】下列图示与对应的叙述不相符的是( )
A.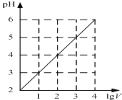
表示1![]() 的
的![]() 溶液加水稀释至VL,pH随lgV的变化
溶液加水稀释至VL,pH随lgV的变化
B.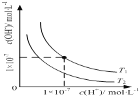
表示不同温度下水溶液中![]() 和
和![]() 浓度的变化的曲线,图中温度
浓度的变化的曲线,图中温度![]()
C.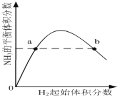
表示一定条件下的合成氨反应中,![]() 的平衡体积分数随
的平衡体积分数随![]() 起始体积分数
起始体积分数![]() 的起始量恒定
的起始量恒定![]() 的变化,图中a点
的变化,图中a点![]() 的转化率小于b点
的转化率小于b点
D.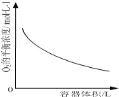
表示同一温度下,在不同容积的容器中进行反应![]() ,
,![]() 的平衡浓度与容器容积的关系
的平衡浓度与容器容积的关系
【答案】A
【解析】
A.醋酸是弱酸,溶液中存在电离平衡,加水稀释平衡正向进行,如稀释![]() 倍,溶液PH增大数值小于n;根据图象,体积增大10n,溶液PH增大n个单位,图像表示强酸加水稀释的pH变化,故A选;
倍,溶液PH增大数值小于n;根据图象,体积增大10n,溶液PH增大n个单位,图像表示强酸加水稀释的pH变化,故A选;
B.水的电离过程是吸热过程,加热促进电离平衡正向进行,温度越高水的离子积常数越大,所以![]() ,图象变化符合离子浓度变化,故不选B;
,图象变化符合离子浓度变化,故不选B;
C.两种反应物增加一种会提高另一种物质的转化率,随氢气体积分数增大,氮气转化率增大,所以图中a点![]() 的转化率小于b点,图象变化符合转化率变化,故不选C;
的转化率小于b点,图象变化符合转化率变化,故不选C;
D.![]() ,正反应是气体体积增大的反应,体积越大浓度越小,平衡向气体体积增大的方向进行,但体积增大对浓度影响大,所以氧气平衡浓度减小,图象变化符合反应变化,故不选D;
,正反应是气体体积增大的反应,体积越大浓度越小,平衡向气体体积增大的方向进行,但体积增大对浓度影响大,所以氧气平衡浓度减小,图象变化符合反应变化,故不选D;
选A。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用![]() 的NaOH溶液滴定
的NaOH溶液滴定![]() 浓度均为
浓度均为![]() 的
的![]() 和
和![]() 溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是![]()
![]()
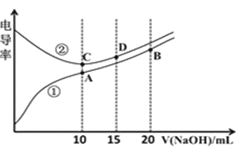
A.C点溶液呈酸性,A点溶液呈碱性
B.A点溶液中:![]()
C.在相同温度下,A、B、C三点溶液中水的电离程度:![]()
D.D点溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
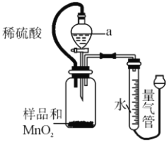
【题目】过氧化镁(MgO2)产品中常混有少量MgO,甲、乙两小组分别设计了两种实验方案测定样品中过氧化镁的质量分数。
方案Ⅰ:取一定量过氧化镁样品,加入少量的MnO2,搅拌使其充分混合,再向其中滴加足量的稀硫酸(如图)。
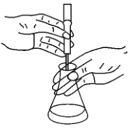
方案Ⅱ:称取0.1000g样品置于碘量瓶中,加入足量KI溶液和稀硫酸,滴加几滴指示剂X,摇匀后在暗处静置5 min,然后用0.1000 mol·L-1 Na2S2O3的标准溶液滴定至终点(如图),消耗Na2S2O3溶液30.00 mL。(已知:I2+2Na2S2O3=Na2S4O6+2NaI)
回答下列问题:
(1)方案Ⅰ实验前检验气密性的方法是________。仪器a的名称是________,使用该仪器的优点是________。
(2)广口瓶内发生的化学反应方程式为:MgO2+H2SO4=MgSO4+H2O2,________。
(3)方案Ⅱ滴定过程中若操作过慢,导致结果________(填“偏高”“偏低”或“无影响”)。指示剂X为________,判断到滴定终点的现象为________。
(4)根据方案Ⅱ实验数据,样品中过氧化镁的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在复习元素化合物的性质时,做了如下学习笔记,请你一起完成。
氯气的颜色为__________;由氯的原子结构示意图推测,氯气具有很强的______ 性。为了证明推测是否正确,进行如下实验:
I:将红热的铁丝伸入盛满氯气的集气瓶,观察铁丝在氯气中燃烧,有大量棕黄色烟。该反应的化学方程式是___________。
II:在空气中点燃H2,然后将导管缓缓伸入盛满氯气的集气瓶,可观察到H2在氯气中安静燃烧,产生______色的火焰,瓶口有白雾的现象。
由实验I、II可知,上述推测_____(填“正确”或“不正确”)。
III:将氯气溶于水,制得氯水。下列物质不能与新制氯水反应的是_____。
A.Na2CO3溶液 B.FeCl2溶液 C.AgNO3 溶液 D.CuCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.PM2.5是指大气中直径≤2.5×10-6 m的颗粒物,则受PM2.5污染的大气定能产生丁达尔效应
B.根据电解质在水溶液中电离的程度,将电解质分为强电解质和弱电解质
C.黑火药的配方为“一硫二硝三木炭”,其中“硝”是指硝酸
D.![]() 、
、![]() 是制造氢弹的原料,它们是同一种核素
是制造氢弹的原料,它们是同一种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的![]() ,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用
,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用![]() 外,还能得到一种复合肥料。
外,还能得到一种复合肥料。
(1)①若氨水与![]() 恰好完全反应生成正盐,则此时溶液呈________性
恰好完全反应生成正盐,则此时溶液呈________性![]() 填“酸”或“碱”
填“酸”或“碱”![]() 。常温下弱电解质的电离平衡常数如下:氨水
。常温下弱电解质的电离平衡常数如下:氨水![]()
![]() 溶液中通入________气体可使溶液呈中性。
溶液中通入________气体可使溶液呈中性。![]() 填“
填“![]() ”或
”或![]() ”
”![]() 此时溶液中
此时溶液中![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]()
(2)向![]() 溶液通入过量
溶液通入过量![]() ,充分反应后所得溶液中离子浓度大小顺序为________________。
,充分反应后所得溶液中离子浓度大小顺序为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH=+140.5 kJ·mol-1
C(s,石墨)+O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)===TiCl4(l)+2CO(g)的ΔH是
A.-80.5 kJ·mol-1 B.+30.0 kJ·mol-1
C.-30.0 kJ·mol-1 D.+80.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g)![]() cC(g)表示]的化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图象,下列判断正确的是( )
cC(g)表示]的化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图象,下列判断正确的是( )
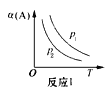
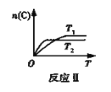


A.反应I:若p1>p2,则此反应只能在高温下自发进行
B.反应Ⅱ:此反应的△H<0,且T1<T2
C.反应Ⅲ:表示t1时刻一定是使用催化剂对反应速率的影响
D.反应Ⅳ:表示t1时刻增大B的浓度对反应速率的影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com