
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | 淀粉溶液遇碘变成蓝色,可用于检验碘单质的存在 | |
| C. | Fe在常温下遇浓硫酸发生钝化,可用铁制容器盛放冷的浓硫酸 | |
| D. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
分析 A.SO2用于漂白纸浆是由于具有漂白性;
B.淀粉遇到碘单质显示蓝色是淀粉的特性;
C.铁、铝在常温下与浓硫酸、浓硝酸发生钝化;
D.Zn的活泼性较强,在锌锰干电池中作负极材料.
解答 解:A.SO2用于漂白纸浆是由于具有漂白性,反应类型为化合反应,与氧化性、还原性无关,故A错误;
B.碘单质遇到淀粉显示蓝色,据此可检验碘单质的存在情况,故B正确;
C.Fe在常温下遇浓硫酸发生钝化,阻止了反应的继续进行,故可用铁制容器盛放冷的浓硫酸,故C正确;
D.Zn为活泼金属,具有良好的导电性,易失去电子,可作原电池的负极,故D正确;
故选A.
点评 本题考查较为综合,考查了物质性质方案的设计与评价,题目难度不大,注意把握盐类水解的原理和应用,学习中注意掌握常见元素化合物的知识.


科目:高中化学 来源: 题型:选择题
| A. | 取用钠、钾、白磷时,没用完的药品要放回原瓶 | |
| B. | 用pH试纸测得氯水的pH为2 | |
| C. | 氯水、硝酸银溶液存放在配有磨口塞的棕色细口瓶中 | |
| D. | 金属钠着火时,用细沙覆盖灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3→Fe(NO3)3+NO↑+H2O.
向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3→Fe(NO3)3+NO↑+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
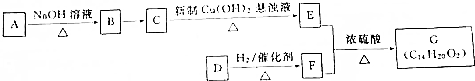
 或
或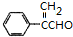 .
.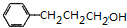 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$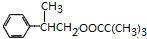 +H2O或(CH3)3CCOOH+
+H2O或(CH3)3CCOOH+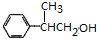 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$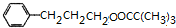 +H2O.
+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14CO2的结构式为O═14C═O | B. | 14CO2和12CO2互为同分异构体 | ||
| C. | 14C和12C互为同素异形体 | D. | 14CO2和Na218O2反应生成15O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多的化合物及其化学反应,如铁与水的反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H
铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多的化合物及其化学反应,如铁与水的反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com