
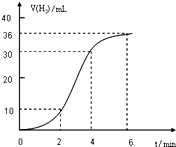
 在试管中加入一定量的盐酸和Al条,H2体积随时间变化的图象如图,该实验结果中能说明“温度越高,反应速率越快”的事实是
在试管中加入一定量的盐酸和Al条,H2体积随时间变化的图象如图,该实验结果中能说明“温度越高,反应速率越快”的事实是

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
| A、乙醇(乙酸) NaOH溶液 分液 |
| B、乙烯(SO2) KMnO4溶液 洗气 |
| C、乙烷(乙烯) H2(催化剂) 催化加氢 |
| D、乙醇(水) CaO 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石蕊可作为判断终点的指示剂 |
| B、滴定时,控制滴加速率:先快后慢 |
| C、标准溶液的浓度越大,滴定误差越小 |
| D、滴定时,眼睛注视滴定管内液面的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、NO3-、K+、SO42ˉ |
| B、Ca2+、H+、CO32ˉ、Cl- |
| C、OHˉ、SO42ˉ、NH4+、Al3+ |
| D、Fe3+、Mg2+、NO3ˉ、Clˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑥ | B、②③④⑤ |
| C、③ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在使用过程中,电池负极区溶液pH值增大 |
| B、在使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C、Zn是负极,Ag2O是正极 |
| D、Zn电极发生还原反应,Ag2O电极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、测定中和热时,大小两烧杯间填满碎纸的作用只是固定小烧 杯 |
| B、若用50mL 0.55mo1?L-1的氢氧化钠溶液,分别与50mL 0.50mo1?L-1的盐酸和50mL 0.25mo1?L-1的硫酸充分反应,两反应测定的中和热不相等 |
| C、实验时需要记录初始温度T1和最高温度T2 |
| D、酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com