
分析 (1)难溶电解质的溶解平衡及沉淀转化是溶解度大的物质向溶解度小的物质转化;
(2)根据元素的化合价变化判断,得电子化合价降低的物质是氧化剂;SO2具有漂白性,能使品红溶液褪色,加热恢复原色;
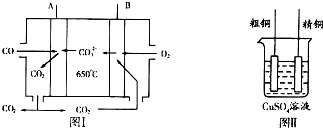
(3)①原电池负极发生氧化反应,正极发生还原反应,所以通入氧气的一极为正极,通入CO的一极为负极;
②粗铜精炼时,粗铜作阳极,与电源的正极相连;粗铜中的Au、Ag,它们在电解槽中的下方,以单质形式沉积在阳极下方;Fe以Fe2+的形式进入电解液中;
③根据电子得失守恒以及精铜中铜离子得到电子来计算;
(4)先生成CuCO3沉淀,说明溶液中铜离子生成碳酸铜沉淀需要的碳酸根离子浓度$\frac{Ksp(CuC{O}_{3})}{c(C{u}^{2+})}$小于钙离子生成碳酸钙沉淀需要的碳酸根离子浓度$\frac{Ksp(CaC{O}_{3})}{c(C{a}^{2+})}$,据此进行解答.
解答 解:(1)ZnS的溶解度小于铜蓝(CuS),CuSO4转变为铜蓝的离子方程式:Cu2+(aq)+ZnS(s)=Zn2+(aq)+CuS(s),故答案为:Cu2+(aq)+ZnS(s)=Zn2+(aq)+CuS(s);
(2)2Cu2O+Cu2S$\frac{\underline{\;高温\;}}{\;}$6Cu+SO2↑,该反应中铜的化合价由+1价变为0价,铜元素在该反应中得电子化合价降低,所以该反应中的氧化剂是Cu2O,Cu2S;
SO2具有漂白性,能使品红溶液褪色,加热恢复原色,所以将气体通入品红溶液溶液褪色,加热恢复原色,
故答案为:Cu2O,Cu2S;将气体通入品红溶液溶液褪色,加热恢复原色;
(3)①CO具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CO-2e-+CO32-═2CO2,
故答案为:CO-2e-+CO32-=2CO2.
②因A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极B相连;Au、Ag比较稳定,不反应,以单质形式沉积在c(阳极)下方,Fe失去电子变成Fe2+的形式进入电解液中;
故答案为:B; Au、Ag以单质形式沉积在阳极下方,Fe以Fe2+的形式进入电解液中;
③当消耗标准状况下1.12L CO时,电极反应式:CO-2e-+CO32-=2CO2,失去电子为$\frac{1.12L}{22.4L/mol}$×2=0.1mol,精铜电极电极反应式:Cu2++2e-=Cu,由电子得失守恒可知Cu2+的物质的量为$\frac{0.1mol}{2}$=0.05mol,精铜电极的质量增加的质量为:0.05mol×64g/mol=3.2g,
故答案:增加3.2g;
(4)碳酸铜、碳酸钙的溶度积分别为:Ksp(CuCO3)=c(Cu2+)•c(CO32-)、Ksp(CaCO3)=c(Ca2+)•c(CO32-),向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,说明铜离子生成碳酸铜沉淀需要的碳酸根离子浓度小于钙离子生成碳酸钙沉淀需要的碳酸根离子,即$\frac{Ksp(CuC{O}_{3})}{c(C{u}^{2+})}$<$\frac{Ksp(CaC{O}_{3})}{c(C{a}^{2+})}$,整理得:$\frac{{c(C{u^{2+}})}}{{c(C{a^{2+}})}}$>$\frac{{{K_{SP}}(CuC{O_3})}}{{{K_{SP}}(CaC{O_3})}}$,故答案为:C.
点评 考查溶解平衡以及沉淀的转化、氧化还原反应的判断、SO2的检验、电极反应式的书写以及有关计算、粗铜的精炼等知识,注意知识的迁移应用是关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 元素的单质氧化性:Z>Y>X | B. | 最高正化合价:Z>Y | ||
| C. | 原子半径:Z<Y<X | D. | 气态氢化物的稳定性:Z<Y<X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
. .
.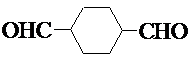 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
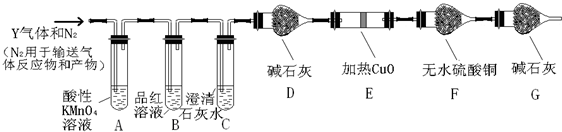
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3溶液中:c(H+)+c(HSO3-)+2c(H2SO3)═c(OH-) | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 有些化学反应既属于复分解反应又属于氧化还原反应 | |
| D. | 常温下,将pH=3的HA和PH=11的BOH等体积混合后pH>7,可能生成了弱酸强碱盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化工生产中应遵循“绿色化学”的思想 | |
| B. | 在元素周期表的过渡元素中寻找优良的催化剂 | |
| C. | 汽车尾气中产生NO的原因是空气中的N2与O2在汽车汽缸内的高温环境下发生反应的产物 | |
| D. | 根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-3 mol•L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A. | 2 s 内的平均反应速率υ(N2)=1.875×10-4 mol•L-1•s-1 | |
| B. | 在该温度下K=5 | |
| C. | 若将容积缩小为原来的一半,NO 转化率大于90% | |
| D. | 某时刻再充入0.1 mol NO,0.36 mol CO,重新达平衡后CO 浓度比原平衡大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com