
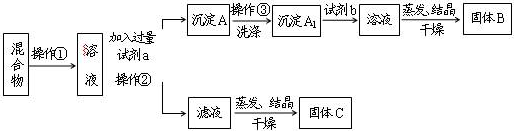
���� ����KCl��BaCl2���ֹ��������������ˮ��Ȼ��������K2CO3ʹBaCl2ת��Ϊ���������˺�����������������BaCl2��Һ�����������ᾧ�������ɵù���BaCl2��������������ҺΪKCl��K2CO3�Ļ���Ӧ�����������ɵ�KCl���Դ˽����⣮
��� �⣺����KCl��BaCl2���ֹ��������������ˮ��Ȼ��������K2CO3ʹBaCl2ת��Ϊ���������˺�����������������BaCl2��Һ�����������ᾧ�������ɵù���BaCl2��������������ҺΪKCl��K2CO3�Ļ���Ӧ�����������ɵ�KCl��
��1�������������Һ��Ӧ��ˮ�ܽ⣬������Ϊ�����Һ��ķ��룬Ϊ���˲������ʴ�Ϊ���ܽ⣻���ˣ�
��2�������ܽ��������K2CO3ʹBaCl2ת��Ϊ���������˺�����������������BaCl2��Һ�����������ᾧ�������ɵù���BaCl2��
�ʴ�Ϊ��K2CO3��HCl��BaCl2��
��3�������Լ�a��K2CO3��BaCl2��Ӧ����BaCO3���������������ӷ���ʽΪCO32-+Ba2+=BaCO3����
�����Լ�b��BaCO3�����������������BaCl2��Һ����Ӧ�����ӷ���ʽΪBaCO3+2H+=Ba2++CO2��+H2O��
�ʴ�Ϊ��CO32-+Ba2+=BaCO3����BaCO3+2H+=Ba2++CO2��+H2O��
��4����ҺΪKCl��K2CO3�Ļ����������ᾧǰӦ��������ϡ���ᣬ��������̼���ת�����Ȼ��أ��ʴ�Ϊ������Ӧ��Һ�м������������������ᾧ��
���� ���⿼�����ʵķ��롢�ᴿ����������ѧ���ķ�����ʵ�������Ŀ��飬��Ŀ�ѶȲ���ע��������ʵ����ʣ���������ѡ��Ӧ�Լ������ջ�ѧ����ʵ�����֪ʶ��


 һ��һ����ʱ���ϵ�д�
һ��һ����ʱ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 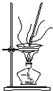 �����ڳ�ȥ̼���ƹ����к��е�����̼������ | |
| B�� | 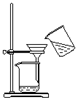 ������̼��ƹ�����Ȼ�����Һ�ķ��� | |
| C�� | 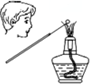 ����ȷ�۲��Ԫ����ɫ��Ӧ | |
| D�� | 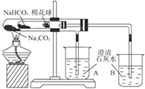 С�Թ���NaHCO3�ֽ⣬��B���г���ʯ��ˮ����ǣ���A���г���ʯ��ˮû���ǣ�˵���ȶ���Na2CO3��NaHCO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Ӧ���ڷֽⷴӦ��������ԭ��Ӧ | |
| B�� | ������������Σ��÷�Ӧ�������ӷ�Ӧ | |
| C�� | ������Ӧ˲������ĸ����������ƶ��ɴ����е���Ҫ���� | |
| D�� | �ڷ�Ӧ��NH4ClO4�������������ǻ�ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NO2-���������� Na2O2-���������� Al2O3-���������� | |
| B�� | ����-����� ����-������ ���ʯ-���� | |
| C�� | ����-�� ����-�� С�մ�-��ʽ�� | |
| D�� | Һ��-�ǵ���� ���ᱵ-ǿ����� ����-������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ʱ�䣨h�� ���ʵ�����mol�� | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1L0.5mol•L-1��ˮ������NH4+��Ϊ0.5NA | |
| B�� | 1molFe������������Ӧת�Ƶĵ�����Ϊ2NA | |
| C�� | ��״���£�33.6LCO2Լ����1.5NA������ | |
| D�� | 1mol 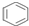 �к�̼̼˫����Ϊ3NA �к�̼̼˫����Ϊ3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com