
| A. | Fe2+、Na+、SO42-、NO3- | B. | Na+、K+、Al3+、NO3- | ||
| C. | K+、Mg2+、Cl-、SO42- | D. | NH4+、Cl-、K+、SO42- |
分析 常温下,若溶液中由水电离产生的 c(H+)=1×10-12mol/L<10-7mol/L,说明水的电离被抑制,则溶液为强酸性或强碱性溶液,离子之间不反应且和氢离子或氢氧根离子不反应的一定能大量共存,以此解答该题.
解答 解:A.如溶液呈酸性,Fe2+与NO3-发生氧化还原反应而不能大量存在,如溶液呈碱性,则Fe2+不能大量存在,故A选;
B.酸性条件下,离子之间不发生任何反应,可大量共存,故B不选;
C.酸性条件下,离子之间不发生任何反应,可大量共存,故C不选;
D.酸性条件下,离子之间不发生任何反应,可大量共存,故D不选.
故选A.
点评 本题考查离子共存问题,为高频考点,题目难度不大,本题注意由水电离出来的c(H+)=1×10-12mol/L的溶液,水的电离收到抑制,溶液可能呈酸性,也可能呈碱性.


科目:高中化学 来源: 题型:多选题
| A. | 在任何条件下,化学平衡常数都是一个定值 | |
| B. | 当改变反应物的浓度时,化学平衡常数会发生改变 | |
| C. | 化学平衡常数K只与温度有关,与反应物浓度、体系的压强无关 | |
| D. | 化学平衡常数K可以推断一个可逆反应进行的程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
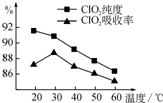 某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液.在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2的吸收率,具体情况如图所示.
某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液.在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2的吸收率,具体情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间(min) | 0 | 5 | 15 | 17 | 20 |
| X的浓度(mol/L) | 1.0 | 0.4 | 0.4 | 0.7 | 0.7 |
| A. | 0~5 min时,该反应的速率为v(X)=0.12 mol/(L•min) | |
| B. | 5 min时反应达到第一次平衡,该温度下的平衡常数数值为0.625 | |
| C. | 15 min时改变的条件不可能是升高温度 | |
| D. | 从初始到18 min时,X的转化率为30% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、CH3COO-、Cl- | B. | Mg2+、Ba2+、Br- | ||
| C. | Mg2+、Cl-、I- | D. | Na+、NH4+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{b}{2a}$mol-1 | B. | $\frac{a}{4b}$mol-1 | C. | $\frac{a}{b}$mol-1 | D. | $\frac{b}{a}$mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g NO2和N2O4混合气体中含有原子数为3NA | |
| B. | 标准状况下22.4 L HF中含原子数为2NA | |
| C. | 1L 1mol/L醋酸溶液中离子总数为2NA | |
| D. | 7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com