
| A. | 硝基苯中混有浓硝酸,加入足量稀NaOH溶液洗涤,振荡,用分液漏斗分液 | |
| B. | 乙烯中混有SO2、CO2,将其通入NaOH溶液洗气 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸氢钠溶液的洗气瓶 | |
| D. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 |
分析 A.硝酸与氢氧化钠溶液反应;
B.CO2和SO2均与NaOH反应,而乙烯不能;
C.二氧化硫与碳酸氢钠溶液反应生成二氧化碳;
D.乙烯与氢气发生加成反应,但乙烷中易引入新杂质氢气.
解答 解:A.硝基苯不溶于水,硝酸与氢氧化钠溶液反应,可分液分离,故A正确;
B.CO2和SO2均与NaOH反应,而乙烯不能,则通入NaOH溶液中洗气可除杂,故B正确;
C.二氧化硫与碳酸氢钠溶液反应生成二氧化碳,则气体通过盛饱和碳酸氢钠溶液的洗气瓶可分离,故C正确;
D.乙烯与氢气发生加成反应,但乙烷中易引入新杂质氢气,不能除杂,应选溴水洗气,故D错误;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应及混合物分离方法选择为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识与实验相结合,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
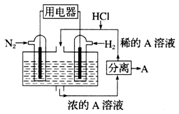 科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )
科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )| A. | A为NH4Cl | |
| B. | 反应过程中溶液的pH会变大,故需要加入盐酸 | |
| C. | 该电池外电路电子从通入N2的电极流向通入H2的电极 | |
| D. | 通入N2的电极发生的电极反应式为N2+6e-+8H+=2NH+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下都不能用铝制容器贮存 | |
| B. | 滴在紫色石蕊试纸上,试纸都变黑 | |
| C. | 常温下都能与铜较快反应 | |
| D. | 露置在空气中,容器内酸液的浓度都降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol ICl溶于NaOH溶液中生成NaC1和NaIO时,转移的电子数为NA | |
| B. | 常温下,1 L PH=2的HC1溶液和1 L PH=1的CH3COOH溶液混合后,混合溶液中所含的氢离子数目大于0.11NA | |
| C. | 常温下,含有NA个NO2和N2O4分子的混合气体,温度降至标准状况,其体积约为22.4 L | |
| D. | 常里常压下,18g D2O中所含中子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{Ba(NO_{3})_{2}}{→}$BaSO4 | |
| B. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH(aq)}{→}$Na2SiO3(aq) | |
| C. | MgCl2•6H2O$\stackrel{△}{→}$MgCl2$\stackrel{电解}{→}$Mg | |
| D. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28gN2所含原子数为NA | B. | 0.5molH2O所含原子数为1.5NA | ||
| C. | 1molH2O含有的水分子数目为NA | D. | 0.5NACl2分子的物质的量是0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 装置 | 操作 | 现象 |
 | 向2mL1mol•L-1FeCl3溶液中,逐滴滴加1mo•L-1Na2SO3溶液2mL | 溶液黄色逐渐加深,最终得红褐色溶液(W) |
| 装置 | 操作 | 现象 |
 | 取1mL溶液W于试管中,向其滴加过量盐酸,再滴加5滴BaCl2溶液 | 产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、S2O32-、SO42-、Na+ 能大量共存于同一溶液中 | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:Ba2+、Na+、ClO-、NO3-能大量共存 | |
| C. | 在含1mol FeI2的溶液中,通入1mol Cl2发生的离子反应为:2Fe2++2I-+2Cl2═2Fe3++4Cl-+I2 | |
| D. | 在NH4HSO4溶液中滴加少量Ba(OH)2溶液:NH4++H++SO42-+Ba2++2OH-═BaSO4↓+NH3•H2O+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com