
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
已知: ①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:
4OH— — 4e— == O2↑+2H2O
B. 为了提高Ni的产率,电解过程中需要控制废水pH
C. 电解过程中,B中NaCl溶液的物质的量浓度将不断减小
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
【知识点】电解原理
【答案解析】C 解析:A、碳棒作阳极,溶液中的氢氧根放电,4OH— — 4e— == O2↑+2H2O,故A正确;B、镀镍铁棒作阴极,溶液中的镍离子放电生成镍,为了提高Ni的产率,电解过程中需要控制废水pH,以保证一直是镍离子放电,故B正确;C、电解过程中,A处的钠离子移动到B处,C处的氯离子也移动到B处,B中NaCl溶液的物质的量浓度将不断增大 故C错误;D、若将图中阳离子膜去掉,将A、B两室合并,则电解阳极就是氯离子放电,反应总方程式发生改变,故D正确。
故答案选C
【思路点拨】本题考查基本电解原理即电极反应式的书写,根据放电顺序即可做出,难度不大。


科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 在常温常压下,11.2LN2含有的分子数为0.5NA |
|
| B. | 标准状况下,22.4LH2和O2的混合物所含有的分子数为NA |
|
| C. | 标准状况下,18gH2O的体积是22.4L |
|
| D. | 1molSO3的体积是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,在不同的时间段,下列说法中正确的是
2C(g),达到平衡后,在不同的时间段,下列说法中正确的是
A.30~40 min间该反应使用了催化剂
B.化学方程式中的x=1,正反应为吸热反应
C.30 min时降低温度,40 min时升高温度
D.8 min前A的平均反应速率为0.08 mol·L-1·min-1

查看答案和解析>>
科目:高中化学 来源: 题型:
己烯雌酚是一种激素类药物,其结构简式如下图所示。下列有关叙述中不正确的是
 A.己烯雌酚的分子式为C18H20O2
A.己烯雌酚的分子式为C18H20O2
B.己烯雌酚分子中一定有16个碳原子共平面
C.己烯雌酚为芳香族化合物
D.己烯雌酚可发生加成、取代、氧化、加聚、酯化、硝化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
我国湖南、广西等地盛产的山苍子油中柠檬醛含量很高,质量分数可达到60%-90%,柠檬醛也可以利用异戊二烯为原料人工合成,柠檬醛又可用来合成紫罗兰酮等香精香料,其合成路线如下:
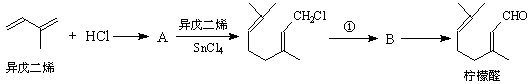


已知:①
②
③同一碳原子连有两个双键结构不稳定。
试根据上述转化关系回答下列问题:
(1)写出A的结构简式 ,C的结构简式 。
(2)①对应的反应条件是 ,反应③的反应类型是 。
(3)写出B转化为柠檬醛的化学方程式 。
(4)根据反应②的反应机理写出CH3CHO与足量的HCHO反应产物的结构简式:
。
(5)检验柠檬醛中含有碳碳双键的实验方法是: 。

 (6)α-紫罗兰酮、β-紫罗兰酮有很多同分异构体,则满足下列条件的同分异构体有 种。
(6)α-紫罗兰酮、β-紫罗兰酮有很多同分异构体,则满足下列条件的同分异构体有 种。
①含有一个苯环 ②属于醇类且不能发生催化氧化反应
③核磁共振氢谱显示有5个峰
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:
 CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
①能说明该反应已达平衡状态的是 。
A. CO2的体积分数在混合气体中保持不变
B. 混合气体的平均相对分子质量不随时间的变化而变化
C. 单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D. 反应中H2O与CH3OH的物质的量浓度之比为1:1,且 保持不变
②下列措施中能使 增大的是 (选填编号)。
增大的是 (选填编号)。
A.升高温度 B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K= 。若改变条件 (填选项),可使K=1。
A.增大压强 B.增大反应物浓度
C.降低温度 D.升高温度 E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。

①M区发生反应的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为
(忽略溶液体积变化)。
(3) 有一种用CO2生产甲醇燃料的方法:
已知: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
存放下列试剂的方法中,有错误并且会引起危险的是 ( )
A.白磷浸在盛有CS2的敞口试剂瓶中 B.金属钠浸在盛有煤油的试剂瓶中
C.浓硝酸存放在棕色试剂瓶中 D.溴水放在带玻璃塞的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 → Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平,不考虑2NO2 N2O4)。
N2O4)。
(1)硝酸在该反应中的作用是__________________。(1分)
(2)0.004molCu被硝酸完全溶解后,Cu失去的电子数是______________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是______________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为____________;所得溶液(假设溶质不扩散)的物质的量浓度是___________ 。
(3)如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式_________________________________________________________。
(4)如果没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组,其原因是_ ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
苯亚甲基苯乙酮俗称查尔酮,淡黄色梭状晶体,熔点58℃,沸点208℃(3.3kp),易溶于醚、氯仿和苯,微溶于醇。制备原理如下:


(1)制备过程中。需在搅拌下滴加苯甲酸,并控制滴加速度使反应温度维持在25~30℃,说明该反应是 (填“放热”或“吸热”)反应。如温度过高时,则可采用 措施。
(2)产品结晶前,可以加入几粒成品的查尔酮,其作用是 。
(3)结晶完全后,需抽滤收集产物。’抽滤装置所包含的仪器除减压系统外还有 、 (填仪器名称)。
(4)获得的深色粗产品加入活性炭,用95%乙醇重结晶即得查尔酮晶体,可通过 法判断原料是否反应完全以及反应的转化率和选择性。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com