
下列说法正确的是( )
A.比例模型 :可以表示二氧化碳分子,也可以表示水分子
:可以表示二氧化碳分子,也可以表示水分子
B.室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合溶液的pH=5,则混合溶液中由水电离出的c(H+) =1×10-5 mol/L
C.纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于-183℃时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同位素
D.已知 Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-4 mol·L-1的AgNO3溶液和
1×10-4 mol·L-1 K2Cr04溶液混合,不会有Ag2CrO4沉淀产生
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
某同学欲从溶有苯酚的乙醇中回收苯酚,设计了实验方案,其流程如下,试回答下列问题。
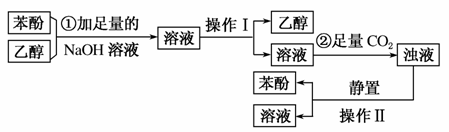
(1)①中加入NaOH溶液后发生的化学反应方程式:__________________________________________。
(2)操作Ⅰ为________,操作Ⅱ为________。
(3)②中通入CO2后发生的化学反应方程式为:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)2NH3(g)
ΔH=-92.4 kJ·mol-1
一种工业合成氨的简易流程图如下:
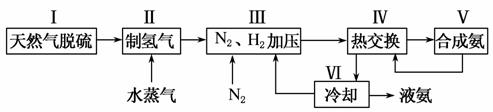
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式_____________________________________________________ _____________________________________________________________________________________。
(2)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)CO(g)+3H2(g)
ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g)
ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是________(填选项字母)。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为______________________ __________________________________________________。
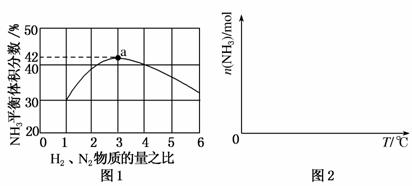
(3)图1表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数为________。
(4)依据温度对合成氨反应的影响,在图2坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的描述和该性质的应用均正确的是( )
A.FeCl3具有氧化性,用FeCl3溶液刻蚀印刷电路板
B.氢氟酸具有强酸性,用氢氟酸蚀刻玻璃
C.过氧化钠只有 氧化性,用过氧化钠为潜水艇舱提供氧气
氧化性,用过氧化钠为潜水艇舱提供氧气
D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式碳酸铝镁
[ MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和____________。
(2)MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为________。
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。
②另取一定量样品在空气中加热,样品的固体残留率(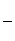 ×100%)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
×100%)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
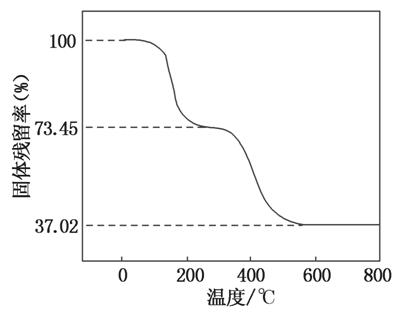
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)n(CO )(写出计算过程)。
)(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气中NOx的消除及无害化处理引起社会广泛关注。
(1)某兴趣小组查阅文献获得如下信息:
N2(g)+ O2(g)= 2NO(g) △H= + 180.5 kJ/mol
2H2(g)+ O2(g)= 2H2O(g) △H= - 483.6 kJ/mol
则反应2H2(g)+ 2NO(g) = 2H2O(g) + N2(g) △H=________。
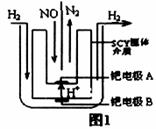 (2)该小组利用电解原理设计了如图1装置进行H2还原NO的实验[高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极]。钯电极A为____极,电极反应式为_______________。
(2)该小组利用电解原理设计了如图1装置进行H2还原NO的实验[高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极]。钯电极A为____极,电极反应式为_______________。
(3)污染物NO、NO2也可以用烧碱溶液吸收,生成物中无气体,该反应的离子方程式为______________________________________________。只有NO2也能与NaOH溶液反应,生成NaNO2 和NaNO3 。现用某烧碱溶液完全吸收n mol NO2和m mol NO组成的混合气体,若所得溶液中c(NO3-): c(NO2-) = 1:9,则原混合气体中NO2和NO的物质的量之比n:m =_______________ 。
(4)下列有关含氮元素溶液的说法正确的是______________
A.c(NH4+)相等的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液中,
c[(NH4)2Fe(SO4)2] > c[(NH4)2SO4]>c[(NH4)2CO3]
B.常温下,等体积的pH=13的NaOH溶液和pH=1的HNO2溶液混合,所得溶液中
c(Na+)>c(NO2—)>c(OH—)>c(H+)
C.某溶液中只存在OH—、H+、Cl—、NH4+四种离子,其离子浓度c(NH4+)>c(Cl—)>c(OH—)>c(H+),则溶液中c(NH3·H2O) + c(NH4+)>c(Cl—)
D.将NH4Cl溶液蒸干制备NH4Cl固体
E.施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用,是因为K2CO3与NH4Cl反应生成氨气会降低肥效
F.反应NH3(g)+HCl(g)=== NH4Cl(s)在室温下可自发进行,则该反应的△H<0
(5) NO2可用氨水吸收生成NH4NO3。25℃时,将a mol NH4NO3溶于水,溶液显酸性、原因是
(用离子方程式表示)。向该溶液滴加氨水至溶液b L时呈中性,则滴加氨水的过程中水的电离平衡将 (填“正向”“不”或“逆向”)移动,所得溶液中氨水的浓度为 mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1)
(6)在恒容密闭容器中,氨基甲酸铵(NH2COONH4)分解反应:
NH2COONH4(s)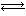 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
① 可以判断该分解反应已经达到平衡的是 。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
② 取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量是 (填“增大”,“减小”或“不变”),平衡常数_________(填“增大”,“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:H2(g)+F2(g) === 2HF(g) △H=-270kJ/mol,下列说法正确的是( )
A.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.2mol氟化氢气体分解成1mol的氢气和1mol的氟气放出270kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
容器中如下反应:X2(g)+Y2(g)  2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A.X2为0.2mol/L B.Y2为0.4mol/L C. Z为0.3mol/L D. Z为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:10AgF+5Cl2+5H2 O===9AgCl+AgClO3+10HF+O2
O===9AgCl+AgClO3+10HF+O2
下列关于该反应的叙述不正确的是( )
A.该反应中,氧化剂与还原剂物质的量之比为95
B.当反应中有1 mol电子转移时,被还原氯气物质的量为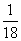 mol
mol
C.每产生1 mol O2时,被氧元素还原的氯气物质的量为2 mol
D.参加反应的水有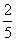 被氧化
被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com