
【题目】三氯氧磷(POCl3)俗名磷酰氯、氧氯化磷,是重要的基础化工原料,可用于制取染料、农药,有机合成的氯化剂、催化剂和阻燃剂等。某化学实验小组模拟PCl3直接氧化法制备POCl3,其实验装置设计如下:
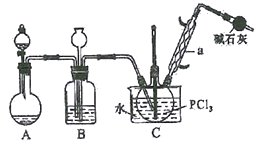
有关物质的部分性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
回答下列问题:
(1)仪器a的名称是__________,装置A中发生反应的化学方程式为__________________。
(2)B中所装试剂为__________,B装置的作用除观察O2的流速之外,还有_____________________。
(3)C装置控制反应在60℃~65℃进行,其控温的主要目的是__________。
(4)实验制得的POCl3粗产品中常含有PCl3,可用__________方法提纯。
(5)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取ag产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液40.00mL,使Cl-完全沉淀。
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖,以防止在滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀。
Ⅳ.加入指示剂,用cmol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是__________ (填标号)。
a.FeCl2 b.甲基橙 c.淀粉 d.NH4Fe(SO4)2
②Cl元素的质量百分含量为__________ (列出算式)。
③在步骤Ⅲ中,若无加入硝基苯的操作,所测Cl-元素含量将会__________(填“偏大”“偏小”或“不变”)。
【答案】 球形冷凝管 2Na2O2+2H2O=4NaOH+O2(或2H2O2![]() 2H2O+O2↑ 浓硫酸 平衡气压、干燥O2 温度过高,PCl3会大量挥发,从而导致产量降低;温度过低,反应速率会变慢 蒸馏 d
2H2O+O2↑ 浓硫酸 平衡气压、干燥O2 温度过高,PCl3会大量挥发,从而导致产量降低;温度过低,反应速率会变慢 蒸馏 d ![]() ×100%[或
×100%[或![]() %] 偏小
%] 偏小
【解析】(1)仪器a的名称是球形冷凝管;由于该实验目的要制备三氯氧磷(POCl3),即氧气与PCl3直接反应,所以装置A为氧气的发生装置,可以用过氧化钠与水反应制备氧气,或双氧水与二氧锰反应制备氧气;化学方程式为 2Na2O2+2H2O=4NaOH+O2或2H2O2![]() 2H2O+O2↑;正确答案:球形冷凝管 2Na2O2+2H2O=4NaOH+O2(或2H2O2
2H2O+O2↑;正确答案:球形冷凝管 2Na2O2+2H2O=4NaOH+O2(或2H2O2![]() 2H2O+O2↑ 。
2H2O+O2↑ 。
(2)该反应需要干燥的环境,因此反应产生的氧气必须干燥,用浓硫酸进行干燥,所以B中所装试剂为浓硫酸;B装置的作用除观察O2的流速之外,还有平衡气压、干燥O2的作用;正确答案:浓硫酸 ;平衡气压、干燥O2 。
(3)根据图表信息可知,PCl3沸点较低,一旦温度过高,PCl3会大量挥发,从而导致产量降低;但是温度过低,反应速率会变慢,因此C装置要控制反应在60℃~65℃进行比较适宜;正确答案:温度过高,PCl3会大量挥发,从而导致产量降低;温度过低,反应速率会变慢。
(4)根据图表信息可知POCl3和PCl3的沸点差别较大,可以采用蒸馏的方法进行POCl3粗产品的提纯;正确答案:蒸馏。
(5)①实验中用NH4SCN溶液滴定过量Ag+,当Ag+反应完全,溶液中存在SCN-,遇铁离子生成红色配合物溶液颜色为红色,所以用NH4Fe(SO4)2做指示剂;正确选项d。
②根据反应SCN-+Ag+= AgSCN↓可知,硝酸银溶液中剩余硝酸银的量为c×V×10-3mol,根据反应Cl--+Ag+= AgCl↓可知,与氯离子反应的硝酸银的量为0.1000×40×10-3-c×V×10-3=4×10-3- cV×10-3 mol;Cl元素的质量百分含量为![]() ×100%[或
×100%[或![]() %] ;正确答案:
%] ;正确答案: ![]() ×100%[或
×100%[或![]() %] 。
%] 。
③氯化银和AgSCN的 Ksp相差不大,在溶液中存在沉淀转化,所以加入有机物覆盖沉淀表面阻断氯化银溶解平衡的转化;若无此操作则第Ⅳ消耗NH4SCN溶液偏高,计算出氯元素含量偏少;正确答案:偏小。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.3.4gNH3中含有的氢原子数为0.6NAB.0.5mol/LNa2CO3溶液中含有的Na+数为NA
C.标准状况下,11.2LH2O含有的原子数为1.5NAD.常温常压下,22.4L臭氧所含原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用混有硫酸亚铁和硫酸镁等杂质的锰矿(含MnO2、MnCO3)生产硫酸锰,实验室模拟生产过程如下:
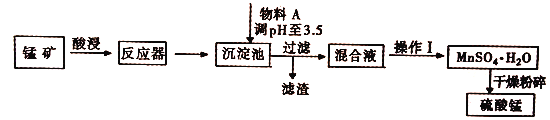
(完全沉淀离子的pH值:Fe3+为3.5,Fe2+为9.5,Mn2+为10.8,Mg2+为11.6)
(1)酸浸中加入的酸是________(填化学式,下同),提高酸浸速率的方法是____(任写一种),从经济效益考虑,物料A可能是___________。
(2)反应器中发生氧化还原反应的离子方程式是___________________ 。
(3)硫酸锰和硫酸镁的溶解度曲线如图所示:
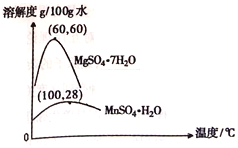
①操作I为:在_____℃下蒸发结晶、趁热过滤。其趁热过滤目的是__________;
②为了得到更纯净的一水合硫酸锰,需将晶体置于过滤器中,用_____进行洗涤(本空格从以下选择)
a.蒸馏水 b.稀硫酸 c.饱和硫酸锰溶液 d.氢氧化钠溶液
(4)MnSO4·H2O在1150℃高温下易分解,产物是Mn304、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种药物合成的中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( )
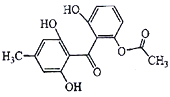
A. 化合物X的分子式为C16H12O6 B. 能发生加成反应、取代反应、消去反应
C. 化合物X的所有碳原子可能共平面 D. 1mol化合物X最多可与8molH2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:2Zn(s) + O2(g) =2ZnO(s) ΔH1=-702.2kJ/mol
Hg(l) + ![]() O2(g) =HgO(s) ΔH2=-90.7kJ/mol
O2(g) =HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3 ,其中ΔH3的值是( )
A. -260.4 kJ/mol B. -254.6 kJ/mol
C. -438.9 kJ/mol D. -441.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是实验室制取少量固体氧化铜的实验,根据实验步骤,回答有关问题。

(1)调整天平零点时,若指针偏向右边,应将左边的螺丝____________(填“向左”或“向右”)旋动。
(2)滴加NaOH溶液,生成沉淀的离子方程式为_______________________________。
(3)加热蒸发过程中要用到玻璃棒,其作用是_________________________________。
(4)洗涤该沉淀的方法是______________________________________________________,为了检验此沉淀是否洗涤干净,应取最后一次的洗涤液少许,加入__________溶液检验。
(5)若向CuSO4溶液中滴加了100mLNaOH溶液,则NaOH溶液的物质的量浓度至少为_________。
(6)理论上最多可以制得CuO的质量为 _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酶指具有生物催化功能的高分子物质.在酶的催化反应体系中,反应物分子被称为底物,底物通过酶的催化转化为其他分子.几乎所有的细胞活动进程都需要酶的参与,以提高效率.请回答下列问题:
(1)酶氧化酶与酚类底物在细胞中能实现分类存放,是因为细胞内具有 系统,组成该系统的结构具有的功能特性是 .茶叶细胞中也存在众多种类的酚类物质与酚氧化酶.绿茶制取过程中必须先进行热锅高温炒制,这一过程的目的是 .
(2)茶树的Rubicon酶在CO2浓度较高时,该酶催化C2与CO2反应,Rubicon酶的存在场所为 ;该酶具有“两面性”,在O2浓度较高时,该酶催化C2与O2反应,产物经一系列变化后到线粒体中会产生CO2,其“两面性”与酶的 (特性)相矛盾.
(3)如图中曲线表示将酶在不同温度下保温足够长时间,再在酶活性最高的温度下测其残余酶活性,由图可得出: .为了验证这一结论,请以耐高温的纤维素分解酶为实验材料,比较在低温和最适温度下储存对酶活性的影响,写出实验设计思路: .
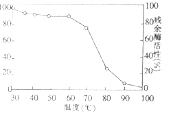
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组能探究发现水果汁中存在电解质,可以设计成如图所示的水果原电池。随后又进一步思考原电池工作效率和其构成要素之间的一些关系如下表所示。
实验次数 | 电极材料 | 水果品种 | 电极间距/cm | 电压/mV | |
1 | 锌 | 铜 | 菠萝 | 3 | 900 |
2 | 锌 | 铜 | 苹果 | 3 | 650 |
3 | 锌 | 铜 | 西红柿 | 3 | 750 |
4 | 锌 | 铝 | 菠萝 | 3 | 650 |
5 | 锌 | 铝 | 苹果 | 3 | 450 |
6 | 锌 | 铝 | 苹果 | 2 | 550 |
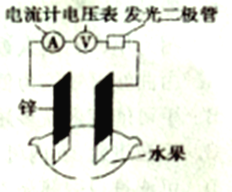
表中数据可知,下列说法不正确的是
A. 实验1、4电流方向应该相反
B. 电极及其间距相同时,电压大小只与水果种类有关,与其他因素无关
C. 如果用锌、碳棒作电极,实验1中电压可能大于900mV
D. 实验中发光二极管不太亮,可用铜锌作电极,用菠萝作介质,并将多个此电池串联起来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光纤通信是70年代后期发展起来的一种新型通信技术,目前长距离光纤通信系统已投入使用,光纤通信的光导纤维是由下列哪种物质经特殊工艺制成的( )
A.石墨
B.石英
C.石灰石
D.高纯硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com